Quando Una Molecola è Polare O Apolare

Capire se una molecola è polare o apolare può sembrare un labirinto all'inizio, lo so bene! Magari ti senti un po' perso tra elettronegatività, dipoli e forze intermolecolari. Ma non preoccuparti, è un argomento che, con un po' di pazienza e le giuste spiegazioni, diventa assolutamente comprensibile. In questo articolo, cercheremo di semplificare il concetto al massimo, fornendoti gli strumenti per navigare in questo mondo affascinante.
La Base: Elettronegatività e Legami
Innanzitutto, partiamo dalle fondamenta: l'elettronegatività. Cos'è? È la capacità di un atomo di attrarre a sé gli elettroni in un legame chimico. Immagina una gara di tiro alla fune: l'atomo più elettronegativo è quello che tira la corda (gli elettroni) con più forza. Elementi come l'ossigeno (O) e il fluoro (F) sono tra i più elettronegativi, mentre elementi come il sodio (Na) e il potassio (K) sono meno elettronegativi.
Quando due atomi si legano, la differenza di elettronegatività tra di loro determina il tipo di legame che si forma. Ci sono due casi principali:
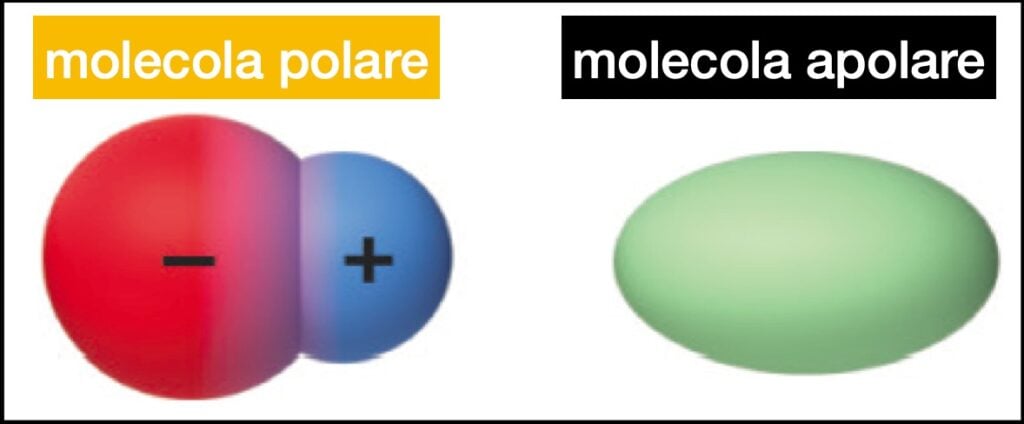
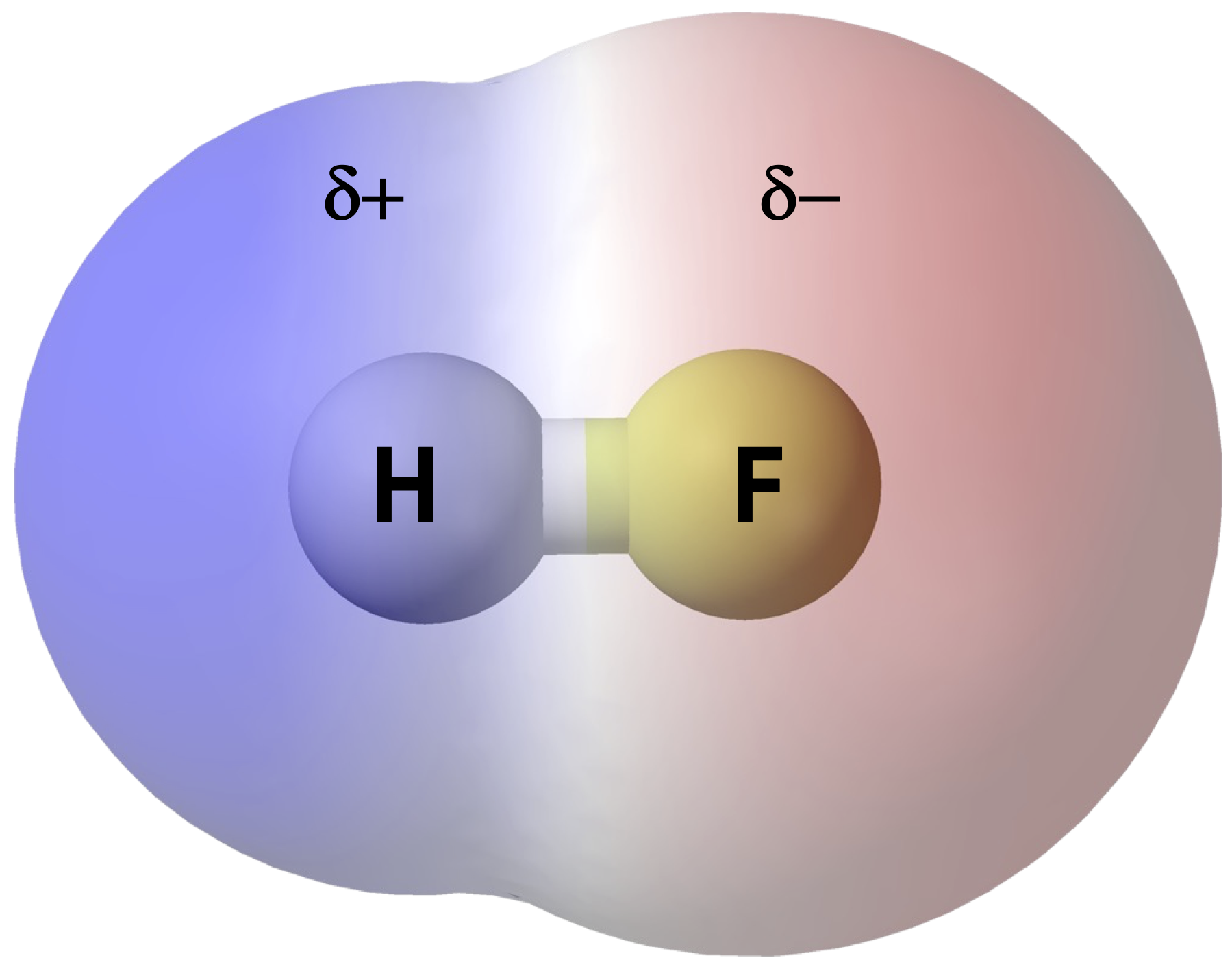
- Legame Covalente Polare: Si verifica quando c'è una differenza significativa di elettronegatività tra i due atomi. Ad esempio, nell'acqua (H2O), l'ossigeno è molto più elettronegativo dell'idrogeno. Quindi, l'ossigeno "tira" gli elettroni verso di sé, creando una parziale carica negativa (δ-) sull'ossigeno e parziali cariche positive (δ+) sugli idrogeni. Questo crea un dipolo, ovvero una separazione di carica all'interno della molecola.
- Legame Covalente Apolare: Si verifica quando la differenza di elettronegatività è minima o assente. Ad esempio, nel legame tra due atomi di idrogeno (H2), entrambi gli atomi hanno la stessa elettronegatività e gli elettroni sono condivisi equamente. Non si crea quindi alcun dipolo. Un altro esempio classico è il legame carbonio-idrogeno (C-H), che viene spesso considerato apolare nonostante una piccola differenza di elettronegatività, perché la differenza è insufficiente per creare un dipolo significativo.
Consiglio per gli studenti: Consulta la tavola periodica e osserva come l'elettronegatività aumenta da sinistra a destra e dal basso verso l'alto. Questo ti aiuterà a prevedere la polarità dei legami.
Dalla Polarità dei Legami alla Polarità della Molecola
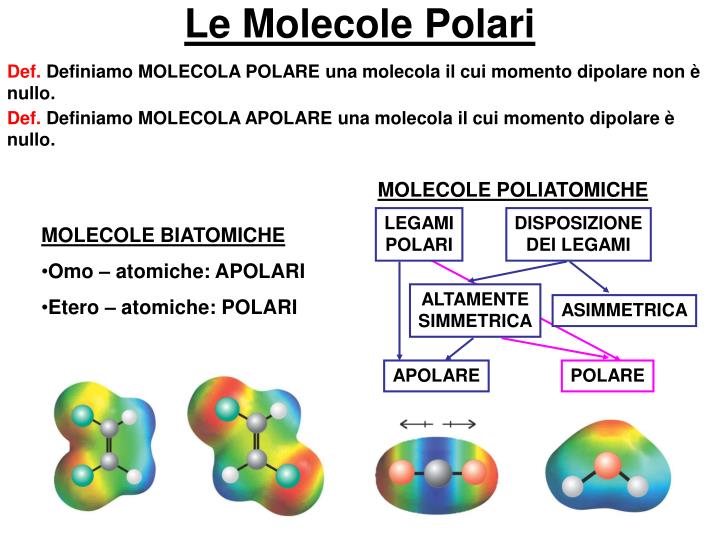
Ora che abbiamo capito la polarità dei legami, il passo successivo è capire come questa si traduce nella polarità dell'intera molecola. Non basta, infatti, che una molecola abbia legami polari per essere considerata polare. La geometria molecolare gioca un ruolo cruciale.
Immagina i dipoli dei legami come delle frecce che puntano verso l'atomo più elettronegativo. Se queste frecce si annullano a vicenda a causa della simmetria della molecola, allora la molecola sarà apolare. Se invece le frecce si sommano, creando un dipolo risultante, allora la molecola sarà polare.
Ecco alcuni esempi:
- Anidride Carbonica (CO2): La molecola di CO2 ha una geometria lineare. Ci sono due legami C=O polari, ma i dipoli si annullano perché sono diretti in direzioni opposte. Quindi, la molecola di CO2 è apolare.
- Acqua (H2O): La molecola di acqua ha una geometria piegata. I due legami O-H sono polari e i dipoli non si annullano perché non sono diretti in direzioni opposte. C'è un dipolo risultante che punta verso l'ossigeno. Quindi, la molecola di H2O è polare.
- Tetracloruro di Carbonio (CCl4): La molecola di CCl4 ha una geometria tetraedrica. I quattro legami C-Cl sono polari, ma i dipoli si annullano a causa della simmetria della molecola. Quindi, la molecola di CCl4 è apolare.
- Ammoniaca (NH3): La molecola di NH3 ha una geometria piramidale trigonale. I tre legami N-H sono polari e i dipoli non si annullano. C'è un dipolo risultante che punta verso l'azoto. Quindi, la molecola di NH3 è polare.
Consiglio per gli studenti: Disegna sempre la struttura di Lewis della molecola e visualizza la sua geometria 3D. Questo ti aiuterà a capire se i dipoli si annullano o si sommano.
L'Importanza della Polarità: Solubilità e Interazioni Molecolari
La polarità di una molecola ha un'influenza enorme sulle sue proprietà fisiche e chimiche. Una delle conseguenze più importanti è la solubilità. La regola generale è "simile scioglie simile": le sostanze polari tendono a sciogliersi in solventi polari, mentre le sostanze apolari tendono a sciogliersi in solventi apolari.
Ad esempio, l'acqua (polare) scioglie bene il sale (ionico, quindi molto polare) e lo zucchero (che contiene gruppi -OH polari), ma non scioglie bene l'olio (apolare). L'olio, invece, si scioglie bene in solventi apolari come l'esano.
La polarità influenza anche le forze intermolecolari, ovvero le forze di attrazione tra le molecole. Le molecole polari possono interagire tramite forze dipolo-dipolo e legami idrogeno (un tipo particolarmente forte di interazione dipolo-dipolo). Le molecole apolari, invece, interagiscono tramite forze di Van der Waals, che sono più deboli.
Queste interazioni influenzano punti di fusione, punti di ebollizione e altre proprietà fisiche.
Applicazioni Pratiche
La comprensione della polarità è fondamentale in molti campi, tra cui:
- Chimica: Per prevedere la reattività delle molecole e la solubilità dei composti.
- Biologia: Per capire come le biomolecole (come proteine e lipidi) interagiscono tra loro e con l'acqua. Ad esempio, la struttura a doppia elica del DNA è stabilizzata da legami idrogeno tra le basi azotate.
- Scienza dei Materiali: Per progettare nuovi materiali con proprietà specifiche.
- Farmacia: Per sviluppare farmaci che si legano in modo specifico a determinate proteine o enzimi.
Ad esempio, nella formulazione di farmaci, la polarità di una molecola è cruciale per la sua capacità di attraversare le membrane cellulari e raggiungere il sito d'azione.
Consigli per Insegnanti e Genitori
Ecco alcuni suggerimenti per rendere l'apprendimento della polarità più efficace e coinvolgente:
- Utilizzare modelli 3D: Mostrare la geometria molecolare con modelli fisici o virtuali aiuta gli studenti a visualizzare la disposizione degli atomi nello spazio.
- Esempi pratici: Collegare il concetto di polarità a fenomeni quotidiani, come la solubilità dello zucchero nel tè o la separazione dell'olio e dell'aceto in un condimento.
- Esperimenti semplici: Realizzare esperimenti che dimostrino la polarità dell'acqua, come la deviazione di un getto d'acqua da una bacchetta caricata elettrostaticamente.
- Utilizzare analogie: Paragonare l'elettronegatività a una forza di attrazione e i dipoli a delle frecce che indicano la direzione di questa forza.
- Incoraggiare la discussione: Creare un ambiente in cui gli studenti si sentano a proprio agio a porre domande e a condividere le proprie difficoltà.
Suggerimento extra per gli insegnanti: Integrare attività interattive online, come simulazioni di polarità molecolare, per rendere l'apprendimento più dinamico e coinvolgente.
Non Arrenderti!
Capire la polarità molecolare richiede tempo e pratica. Non scoraggiarti se all'inizio ti sembra difficile. Continua a studiare, a fare esercizi e a porre domande. Con un po' di impegno, sarai in grado di padroneggiare questo concetto e di applicarlo a una vasta gamma di problemi chimici e biologici. Credi in te stesso e nelle tue capacità!
Ricorda, la chimica è come un puzzle: ogni pezzo (ogni concetto) è importante per completare il quadro generale. E la polarità è un pezzo fondamentale di questo puzzle!
Spero che questo articolo ti sia stato utile. In bocca al lupo con il tuo percorso di apprendimento!