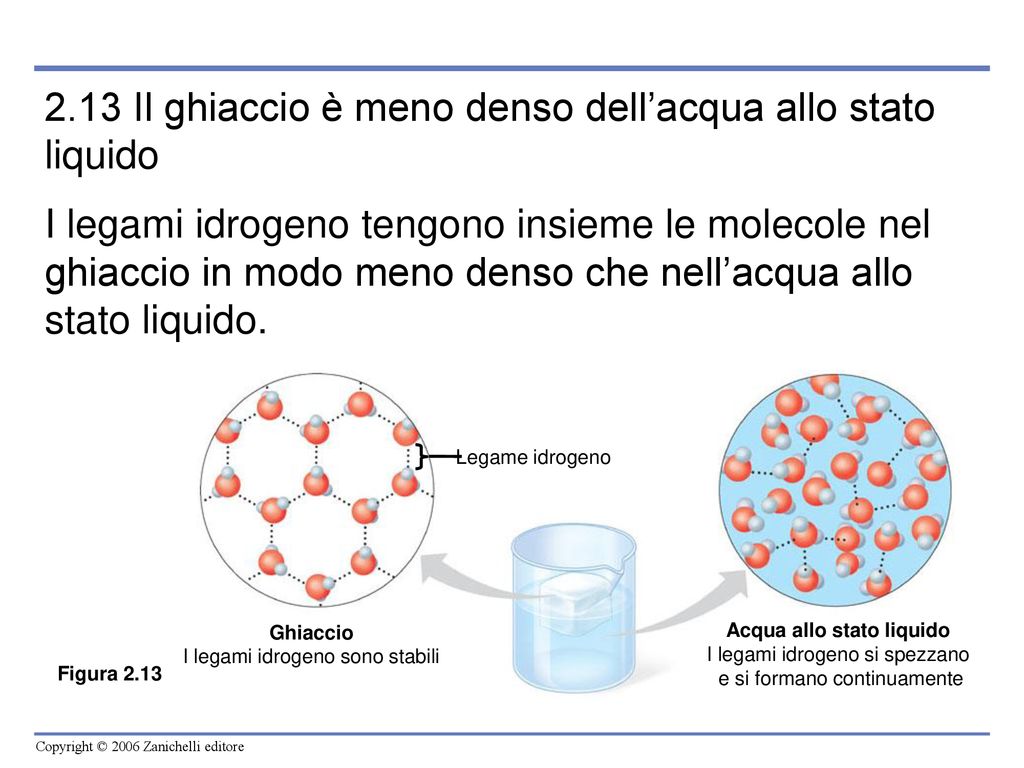
Perchè Il Ghiaccio è Meno Denso Dell'acqua

Ti sei mai chiesto perché un cubetto di ghiaccio galleggia nel tuo bicchiere d'acqua? Sembra un paradosso, no? Dovrebbe affondare, essendo solido. Questa è una domanda che spesso mette in difficoltà gli studenti, un vero rompicapo che merita di essere svelato. Non temere, non sei solo! In questo articolo, esploreremo in dettaglio perché il ghiaccio è meno denso dell'acqua, trasformando questa sfida in una solida comprensione.
La Sfida della Densità: Cos'è e Perché Conta?
Innanzitutto, definiamo la densità. La densità è una misura di quanta massa è contenuta in un determinato volume. Immagina di avere due scatole identiche. Una è piena di piume, l'altra di mattoni. La scatola con i mattoni è molto più pesante, quindi ha una densità maggiore. In termini scientifici, la densità si calcola dividendo la massa per il volume: Densità = Massa / Volume.
Di solito, ci aspetteremmo che un solido sia più denso del suo corrispondente liquido. Questo perché le molecole nei solidi sono generalmente impacchettate più strettamente rispetto ai liquidi, occupando meno volume per la stessa quantità di materia. Ma l'acqua è speciale... molto speciale!
L'Acqua: Una Molecola Eccezionale
La chiave per comprendere l'anomalia dell'acqua risiede nella sua struttura molecolare. La molecola d'acqua (H2O) è composta da due atomi di idrogeno e un atomo di ossigeno. L'ossigeno è più elettronegativo, il che significa che attrae gli elettroni più fortemente degli atomi di idrogeno. Questo crea una polarità: l'ossigeno assume una carica parzialmente negativa (δ-), mentre gli idrogeni assumono cariche parzialmente positive (δ+).
Questa polarità permette alle molecole d'acqua di formare legami idrogeno. Un legame idrogeno si verifica quando l'idrogeno parzialmente positivo di una molecola d'acqua è attratto dall'ossigeno parzialmente negativo di un'altra molecola d'acqua. Questi legami sono relativamente deboli rispetto ai legami covalenti all'interno della molecola d'acqua, ma sono cruciali per le proprietà uniche dell'acqua.
Come i Legami Idrogeno Influenzano la Densità
Quando l'acqua è in forma liquida, i legami idrogeno si formano e si rompono continuamente, permettendo alle molecole d'acqua di scorrere e di avvicinarsi. In questo stato, le molecole sono abbastanza vicine le une alle altre, ma hanno ancora un certo grado di libertà di movimento.
Quando l'acqua si raffredda e si avvicina al punto di congelamento (0°C), l'energia cinetica delle molecole diminuisce. Questo fa sì che i legami idrogeno diventino più stabili e organizzati. Invece di formarsi e rompersi casualmente, le molecole d'acqua iniziano a formare una struttura cristallina tetraedrica. Ogni molecola d'acqua si lega a quattro altre molecole d'acqua attraverso legami idrogeno, creando una rete tridimensionale rigida.
La Struttura Cristallina del Ghiaccio
Questa struttura cristallina è cruciale perché crea uno spazio vuoto tra le molecole d'acqua. In sostanza, il ghiaccio occupa un volume maggiore rispetto alla stessa massa di acqua liquida. Poiché la densità è massa divisa per volume, e il volume è aumentato, la densità del ghiaccio diminuisce.
- Legami Idrogeno Stabili: Nel ghiaccio, i legami idrogeno sono fissi e formano una struttura aperta.
- Aumento del Volume: Questa struttura aperta aumenta il volume occupato dalla stessa massa di acqua.
- Diminuzione della Densità: L'aumento del volume porta a una diminuzione della densità.
Prove Scientifiche e Citazioni
Come afferma il Professor Philip Ball, autore di "H2O: A Biography of Water", "La struttura tetraedrica del ghiaccio è ciò che lo rende meno denso dell'acqua liquida. È una proprietà straordinaria che ha profonde implicazioni per la vita sulla Terra." (Ball, 2001).
Numerosi studi hanno confermato questa anomalia. La diffrazione dei raggi X e la spettroscopia neutronica hanno rivelato la precisa geometria della struttura cristallina del ghiaccio e la sua relazione con la densità (Petrenko & Whitworth, 1999).
Implicazioni Pratiche e Importanza Ambientale
L'anomalia dell'acqua ha implicazioni enormi per la vita sulla Terra:
- Vita Acquatica: Il ghiaccio che galleggia in superficie isola l'acqua sottostante, proteggendo la vita acquatica durante l'inverno. Se il ghiaccio affondasse, i corpi d'acqua gelerebbero dal fondo verso l'alto, uccidendo molte forme di vita.
- Erosione: L'espansione dell'acqua durante il congelamento contribuisce all'erosione delle rocce, un processo importante per la formazione del suolo.
- Clima: La presenza di ghiaccio e neve riflette la luce solare, influenzando il clima globale.
Esperimenti Pratici e Dimostrazioni
Ecco alcuni modi per sperimentare direttamente l'anomalia dell'acqua:
- Congelare una bottiglia d'acqua: Riempi una bottiglia d'acqua di plastica quasi fino all'orlo e mettila nel congelatore. Osserva come la bottiglia si deforma leggermente quando l'acqua si congela, indicando che il volume è aumentato. (Attenzione: non riempire troppo la bottiglia, altrimenti potrebbe rompersi).
- Ghiaccio che galleggia: Metti dei cubetti di ghiaccio in un bicchiere d'acqua. Osserva come galleggiano. Puoi anche aggiungere sale all'acqua per vedere come cambia il punto di congelamento.
- Densità comparata: Prendi due contenitori identici. Riempi uno con acqua liquida e l'altro con un volume equivalente di ghiaccio tritato (assicurati che il ghiaccio sia ben compresso per riempire il volume). Pesa entrambi i contenitori. Il contenitore con l'acqua liquida peserà di più, dimostrando che è più denso.
Strumenti Utili per l'Apprendimento
Per approfondire la tua comprensione, considera l'utilizzo di questi strumenti:
- Modelli molecolari: Utilizza modelli fisici o software per visualizzare la struttura delle molecole d'acqua e i legami idrogeno.
- Simulazioni al computer: Esplora simulazioni online che mostrano come le molecole d'acqua si comportano in diversi stati di aggregazione.
- Video esplicativi: Guarda video animati che spiegano il concetto di densità e l'anomalia dell'acqua. Molti canali di divulgazione scientifica offrono contenuti di alta qualità.
Rafforzare la Comprensione: Un Approccio Passo Passo
Ecco un piano graduale per consolidare la tua conoscenza:
- Definisci la densità: Assicurati di comprendere la definizione di densità e come si calcola.
- Comprendi la polarità dell'acqua: Impara come la polarità della molecola d'acqua porta alla formazione di legami idrogeno.
- Visualizza i legami idrogeno: Immagina come i legami idrogeno influenzano la struttura dell'acqua liquida e del ghiaccio.
- Connetti struttura e densità: Capisci come la struttura cristallina del ghiaccio, con i suoi spazi vuoti, riduce la densità.
- Applica la conoscenza: Pensa alle implicazioni pratiche dell'anomalia dell'acqua per la vita e l'ambiente.
Conclusione: Un Mistero Svelato
L'apparente paradosso del ghiaccio che galleggia sull'acqua è in realtà una conseguenza affascinante della struttura molecolare unica dell'acqua e dei suoi legami idrogeno. Comprendere questo fenomeno non solo approfondisce la tua conoscenza scientifica, ma ti permette anche di apprezzare la bellezza e la complessità del mondo che ci circonda. Quindi, la prossima volta che vedrai un cubetto di ghiaccio galleggiare nel tuo bicchiere, ricorderai di questa speciale proprietà dell'acqua e di come essa rende possibile la vita sulla Terra. Ricorda sempre: la scienza è un viaggio di scoperta, e ogni domanda, anche la più semplice, può aprire la porta a un mondo di conoscenza.







:max_bytes(150000):strip_icc()/ice-172152618-5aec5ac1ff1b780036215a57.jpg)