Equazione Di Stato Dei Gas Ideali
Immagina di essere in montagna, in una baita accogliente. Fuori nevica e dentro scoppietta il fuoco nel camino. Marco, il tuo amico, sta gonfiando un palloncino per festeggiare il suo compleanno. Lo gonfia, lo gonfia… e improvvisamente, il palloncino scoppia! Marco è deluso, ma tu gli ricordi che con l’altitudine, la pressione dell'aria diminuisce e il palloncino, già pieno, non ha retto. Questo semplice episodio ci introduce a un concetto fondamentale della fisica: l'Equazione di Stato dei Gas Ideali.
Questa equazione descrive il comportamento dei gas "ideali", ovvero gas ipotetici in cui le particelle non interagiscono tra loro. Certo, i gas reali si comportano in modo leggermente diverso, ma l'equazione dei gas ideali è un'ottima approssimazione per molte situazioni pratiche.
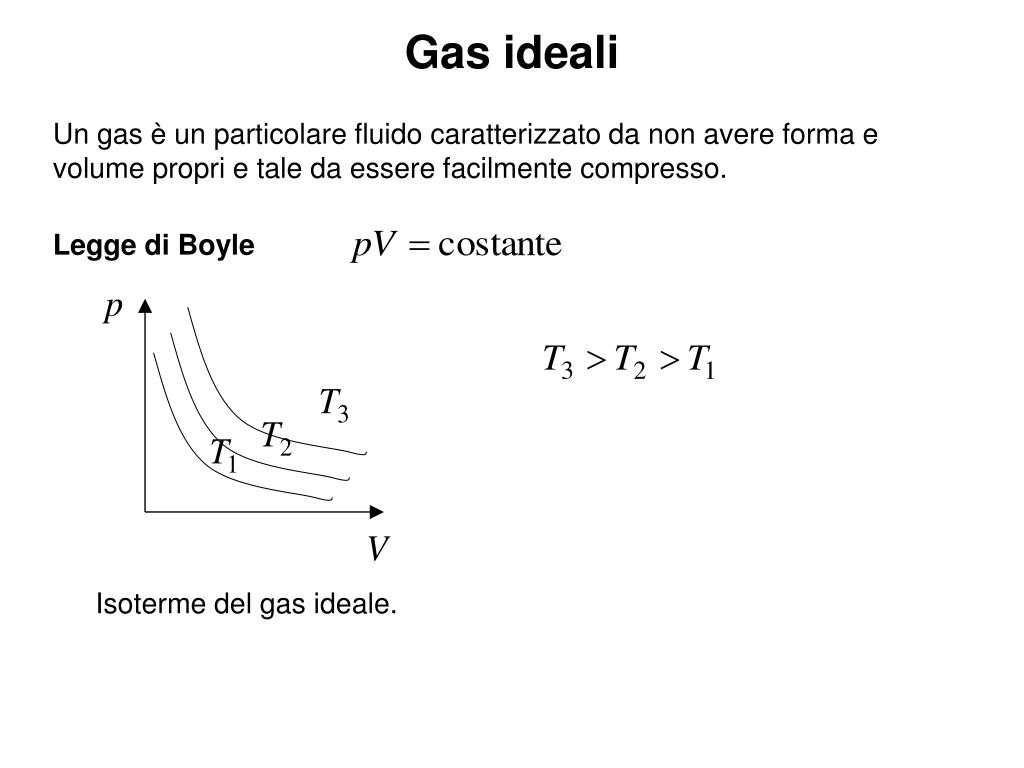
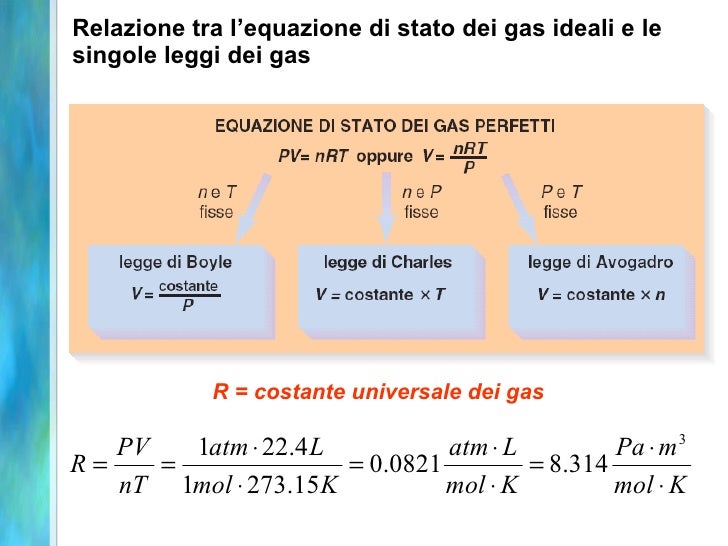
La Formula Magica: PV = nRT
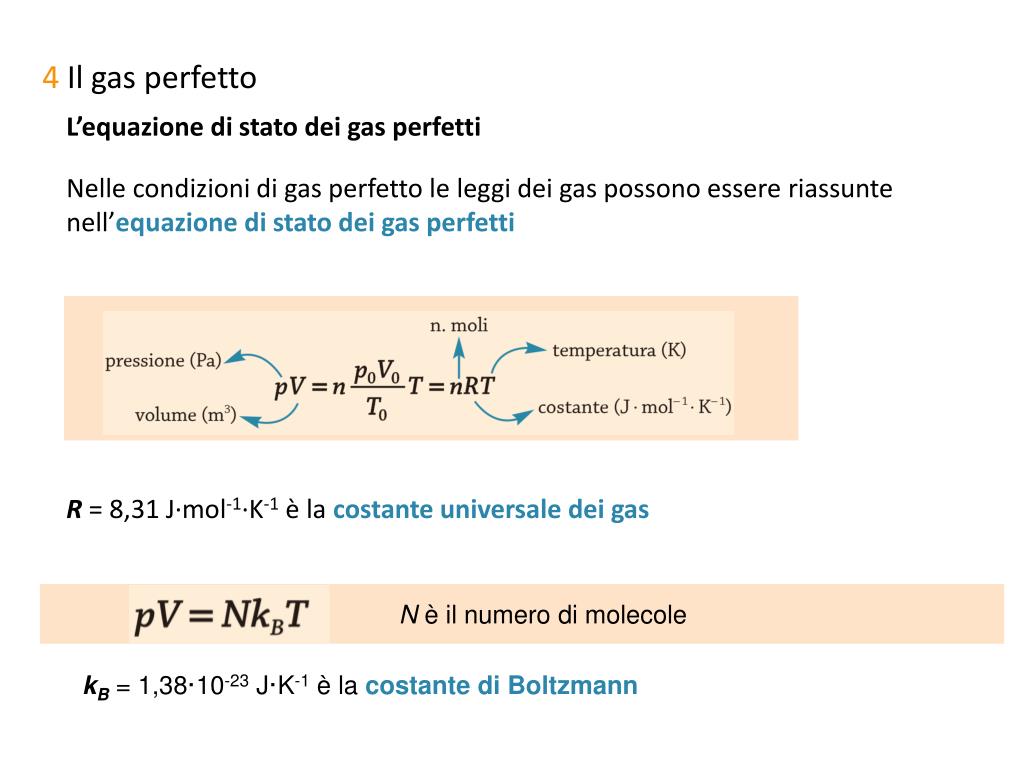
L'equazione dei gas ideali si esprime con una formula semplice ma potente: PV = nRT. Cosa significano queste lettere?
- P rappresenta la pressione del gas (solitamente misurata in Pascal o atmosfere).
- V è il volume occupato dal gas (solitamente misurato in metri cubi o litri).
- n indica il numero di moli del gas, una misura della quantità di sostanza.
- R è la costante universale dei gas, un valore fisso che vale circa 8.314 J/(mol·K).
- T è la temperatura assoluta del gas, misurata in Kelvin. Ricorda, per passare da Celsius a Kelvin, devi aggiungere 273.15!
Cosa ci dice questa equazione?
Questa equazione mette in relazione le quattro grandezze fondamentali che descrivono un gas: pressione, volume, quantità e temperatura. Se conosciamo tre di queste grandezze, possiamo calcolare la quarta. Ad esempio, se riscaldiamo un gas in un contenitore chiuso (volume costante), la pressione aumenterà. Oppure, se aumentiamo la quantità di gas in un contenitore, anche la pressione aumenterà.
Ritornando all'esempio del palloncino di Marco, possiamo capire meglio cosa è successo. Salendo in montagna, la pressione esterna (P) è diminuita. Siccome il numero di moli (n) e la temperatura (T) sono rimasti approssimativamente costanti, per mantenere l'uguaglianza PV = nRT, il volume (V) del palloncino doveva aumentare. Ad un certo punto, il palloncino ha raggiunto il suo limite di elasticità e... boom!
Applicazioni Pratiche (e Qualche Spunto di Riflessione)
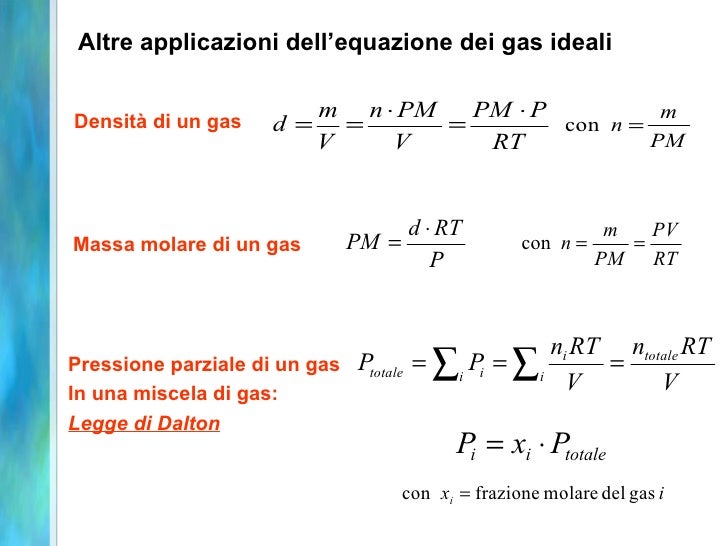
L'equazione dei gas ideali non è solo una formula astratta. Ha applicazioni concrete in molti campi, dalla chimica all'ingegneria. Viene utilizzata per calcolare la quantità di gas necessaria per gonfiare uno pneumatico, per progettare motori a combustione interna, e persino per studiare l'atmosfera terrestre.
"La scienza non è altro che una perversione se non ha come suo fine ultimo il miglioramento delle condizioni dell'umanità." - Nikola Tesla
Ma c'è una lezione più profonda che possiamo trarre da questa equazione. Come le variabili in PV = nRT sono interconnesse, anche le nostre azioni hanno conseguenze. Un piccolo cambiamento in un'area della nostra vita può avere un impatto significativo su altre. La costanza, rappresentata dalla costante R, ci ricorda che ci sono principi fondamentali che rimangono validi, anche quando le circostanze cambiano. Proprio come la temperatura influenza il comportamento di un gas, il nostro "calore" interiore, la nostra passione e motivazione, influenzano il nostro percorso. E come la pressione esterna può comprimere o espandere un palloncino, le pressioni sociali e le aspettative possono influenzare le nostre scelte.
Quindi, la prossima volta che vedrai un palloncino, pensa all'Equazione di Stato dei Gas Ideali e alle sue implicazioni. Pensa a come le piccole cose, i piccoli "gas" della tua vita, influenzano il tuo "volume", la tua presenza nel mondo. E sforzati di mantenere un "equilibrio", una "temperatura" interiore che ti permetta di "espanderti" senza "scoppiare".