Differenza Tra Legame Ionico E Covalente

Ti sei mai chiesto come mai il sale da cucina (cloruro di sodio) si scioglie in acqua mentre l'olio no? La risposta sta nei legami chimici che tengono uniti gli atomi all'interno di queste sostanze. Capire la differenza tra legame ionico e legame covalente è fondamentale per comprendere le proprietà della materia che ci circonda. Non preoccuparti, non serve essere uno scienziato per afferrare i concetti base! Cercheremo di spiegare tutto in modo semplice e pratico.
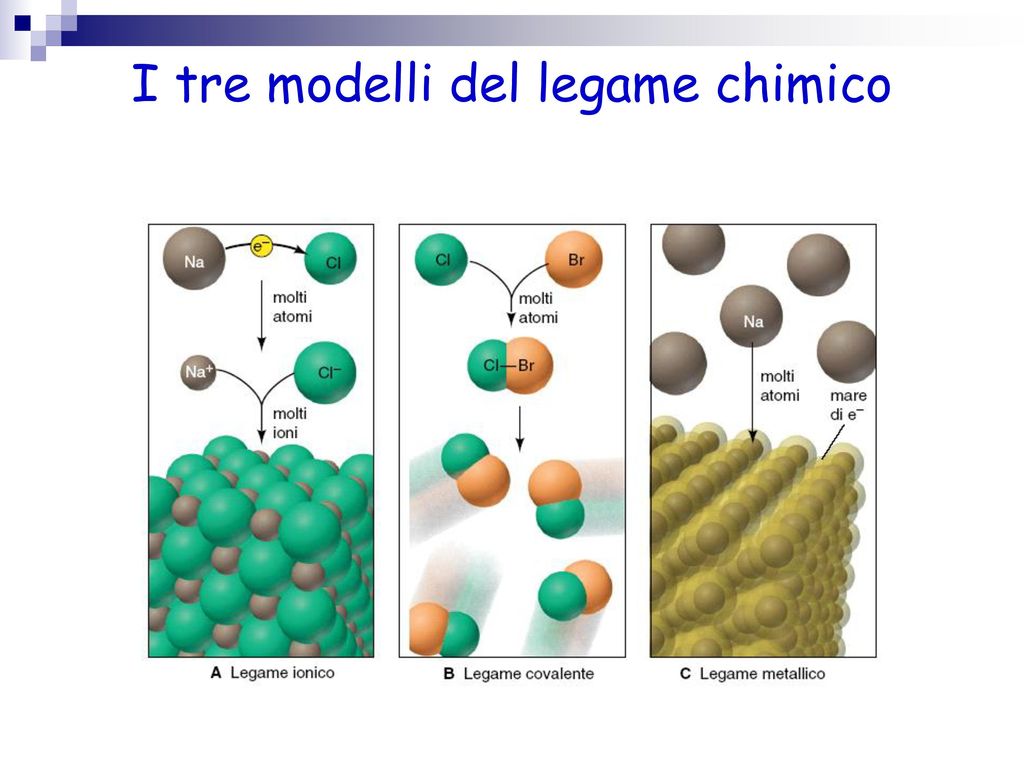
Legame Ionico: Quando gli Atomi "Rubano" Elettroni
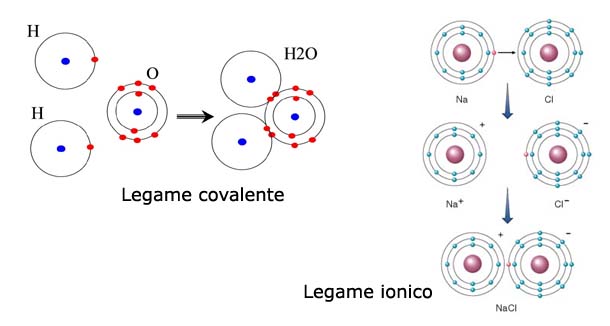
Immagina due persone: una che ha tantissimi soldi e l'altra che è quasi al verde. La persona ricca, per un senso di "giustizia" o convenienza, decide di cedere una parte dei suoi averi all'altra. Questo, in termini atomici, è un legame ionico. Si forma quando un atomo cede uno o più elettroni a un altro atomo. Questo trasferimento di elettroni crea due ioni: uno positivo (catione, l'atomo che ha perso elettroni) e uno negativo (anione, l'atomo che ha guadagnato elettroni). Essendo cariche opposte, questi ioni si attraggono fortemente, formando il legame ionico.
Esempio Pratico: Il Cloruro di Sodio (NaCl)
Il cloruro di sodio, ovvero il comune sale da cucina, è l'esempio per eccellenza di composto ionico. Il sodio (Na) ha un elettrone in più nel suo guscio esterno, mentre il cloro (Cl) ne ha bisogno di uno per completare il suo. Il sodio cede il suo elettrone al cloro. Il sodio diventa uno ione Na+ (positivo) e il cloro diventa uno ione Cl- (negativo). L'attrazione elettrostatica tra questi ioni di carica opposta crea il legame ionico che tiene unita la molecola di NaCl.
Caratteristiche Chiave dei Composti Ionici:
- Solidi a temperatura ambiente: La forte attrazione tra gli ioni crea strutture cristalline ordinate e resistenti.
- Punti di fusione ed ebollizione elevati: Serve molta energia per rompere i forti legami ionici.
- Solubili in acqua: L'acqua, essendo una molecola polare, è in grado di "solvatare" gli ioni, separandoli e disperdendoli.
- Conducono elettricità quando fusi o in soluzione acquosa: Gli ioni mobili possono trasportare la carica elettrica.
Legame Covalente: Quando gli Atomi Condividono Elettroni
Ora, immagina due persone che non hanno abbastanza soldi per comprarsi qualcosa da sole. Invece di darne uno all'altro, decidono di mettere insieme i loro risparmi per raggiungere l'obiettivo. Questo è il legame covalente. In questo tipo di legame, gli atomi condividono uno o più elettroni per raggiungere una configurazione elettronica stabile. Invece di trasferire completamente gli elettroni come nel legame ionico, gli atomi si "accordano" per condividere gli elettroni.
Esempio Pratico: L'Acqua (H2O)
La molecola d'acqua è un ottimo esempio di composto covalente. L'ossigeno (O) ha bisogno di due elettroni per completare il suo guscio esterno, mentre ogni atomo di idrogeno (H) ne ha bisogno di uno. L'ossigeno condivide un elettrone con ciascun atomo di idrogeno, formando due legami covalenti. In questo modo, sia l'ossigeno che l'idrogeno raggiungono una configurazione elettronica più stabile.
Tipi di Legame Covalente:
- Legame Covalente Singolo: Condivisione di una coppia di elettroni (es. H-H).
- Legame Covalente Doppio: Condivisione di due coppie di elettroni (es. O=O).
- Legame Covalente Triplo: Condivisione di tre coppie di elettroni (es. N≡N).
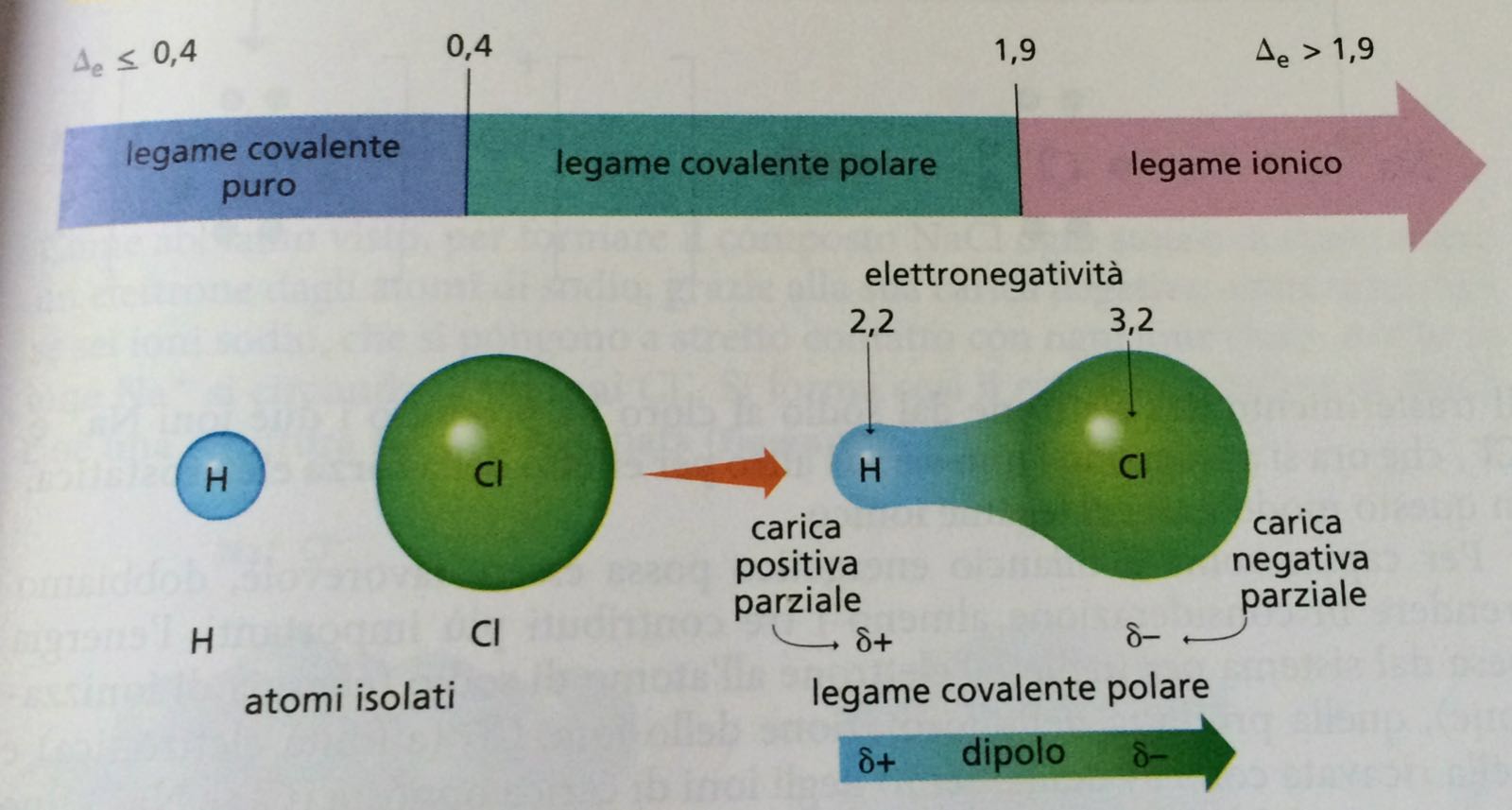
Polarità del Legame Covalente:
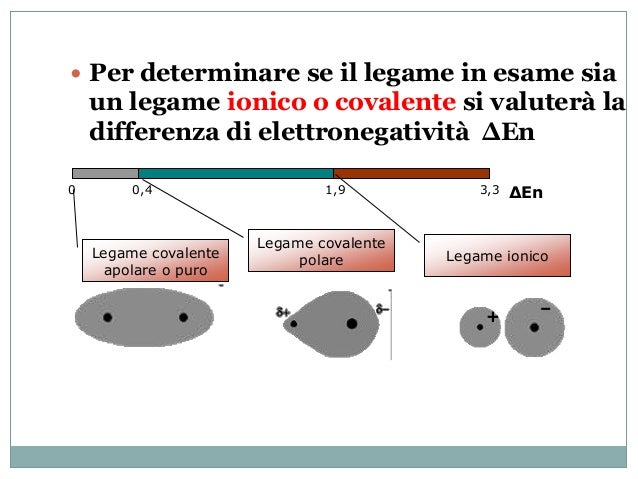
Non sempre la condivisione degli elettroni è equa. Se un atomo è più elettronegativo (cioè attrae gli elettroni con più forza) dell'altro, gli elettroni condivisi saranno più attratti verso l'atomo più elettronegativo. Questo crea un legame covalente polare, in cui un'estremità della molecola è leggermente negativa (δ-) e l'altra è leggermente positiva (δ+). L'acqua (H2O) è un esempio di molecola polare, con l'ossigeno che è più elettronegativo dell'idrogeno.
Se la condivisione degli elettroni è equa, si parla di legame covalente apolare. Un esempio è il legame tra due atomi dello stesso elemento (es. H2, O2).
Caratteristiche Chiave dei Composti Covalenti:
- Possono essere solidi, liquidi o gassosi a temperatura ambiente: Le forze intermolecolari sono generalmente più deboli rispetto ai legami ionici.
- Punti di fusione ed ebollizione generalmente più bassi rispetto ai composti ionici: Meno energia è necessaria per rompere le forze intermolecolari.
- Solubilità variabile: I composti polari tendono a sciogliersi in solventi polari (come l'acqua), mentre i composti apolari tendono a sciogliersi in solventi apolari (come l'olio).
- Generalmente non conducono elettricità: Non ci sono ioni mobili o elettroni liberi di muoversi.
Tabella di Confronto: Legame Ionico vs. Legame Covalente
Per rendere ancora più chiara la differenza, ecco una tabella riassuntiva:
| Caratteristica | Legame Ionico | Legame Covalente |
|---|---|---|
| Formazione | Trasferimento di elettroni | Condivisione di elettroni |
| Tipi di atomi coinvolti | Generalmente tra un metallo e un non metallo | Generalmente tra due non metalli |
| Carica degli ioni | Ioni positivi (cationi) e ioni negativi (anioni) | Nessuna carica formale (ma possono esserci polarità parziali nei legami covalenti polari) |
| Punto di fusione ed ebollizione | Alto | Generalmente basso |
| Solubilità | Generalmente solubile in acqua | Solubilità variabile (dipende dalla polarità) |
| Conducibilità elettrica | Conduce quando fuso o in soluzione | Generalmente non conduce |
E allora, perché l'olio non si scioglie in acqua?
Ora puoi rispondere a questa domanda! L'olio è composto principalmente da molecole organiche con legami covalenti apolari. L'acqua, come abbiamo visto, è una molecola polare. "Simile scioglie simile" è una regola generale: le sostanze polari si sciolgono in solventi polari, e le sostanze apolari si sciolgono in solventi apolari. Poiché l'olio è apolare e l'acqua è polare, non si mescolano.
Conclusione: Comprendere i Legami per Comprendere il Mondo
La differenza tra legame ionico e legame covalente è cruciale per capire le proprietà fisiche e chimiche delle sostanze che ci circondano. Dai cristalli di sale alle molecole d'acqua, dai farmaci che assumiamo ai materiali che costruiamo, la natura dei legami chimici determina il comportamento della materia. Spero che questa spiegazione ti abbia aiutato a comprendere meglio questi concetti fondamentali. Non esitare a approfondire ulteriormente l'argomento, la chimica è un mondo affascinante!











.jpg)

