Curve Di Titolazione Acido Debole Base Forte
Ciao! Se stai leggendo questo articolo, probabilmente ti trovi di fronte al complicato mondo delle titolazioni acido-base, in particolare quelle che coinvolgono un acido debole e una base forte. Non preoccuparti, non sei solo! Molti studenti e professionisti della chimica trovano queste curve di titolazione un po' ostiche. L'obiettivo qui è demistificare il processo e fornirti gli strumenti per comprenderlo a fondo.
Inizieremo col capire perché queste titolazioni sono importanti, analizzeremo passo dopo passo come costruire e interpretare una curva di titolazione acido debole-base forte, e infine discuteremo le implicazioni pratiche di questa conoscenza. Prepariamoci ad affrontare la sfida!
Perché Studiare le Curve di Titolazione Acido Debole-Base Forte?
Potresti chiederti: "Perché dovrei preoccuparmi di queste curve?" La risposta è semplice: sono fondamentali per la chimica analitica e hanno un impatto diretto sulla nostra vita quotidiana. Pensa alla determinazione dell'acidità del suolo per l'agricoltura, al controllo della qualità dei farmaci, o alla misurazione della concentrazione di acidi organici negli alimenti. In tutti questi casi, la titolazione acido-base gioca un ruolo cruciale.
Inoltre, capire queste curve ti permette di:
- Determinare la concentrazione di un acido debole in una soluzione.
- Scegliere l'indicatore acido-base corretto per una titolazione.
- Comprendere come varia il pH durante una reazione acido-base.
- Predire il punto di equivalenza e il punto finale di una titolazione.
Insomma, si tratta di una competenza indispensabile per chiunque lavori in laboratorio o abbia a che fare con processi chimici.
Costruiamo la Curva: Passo Dopo Passo
Ora, passiamo al cuore del problema: come si costruisce una curva di titolazione acido debole-base forte? Cercheremo di rendere il processo il più chiaro possibile.
1. La Reazione Chimica
Il primo passo è comprendere la reazione che avviene. Immagina di titolare l'acido acetico (CH3COOH), un acido debole, con l'idrossido di sodio (NaOH), una base forte. La reazione è la seguente:
CH3COOH (aq) + NaOH (aq) → CH3COONa (aq) + H2O (l)
L'acido acetico reagisce con l'idrossido di sodio per formare acetato di sodio (CH3COONa), un sale, e acqua.
2. Le Fasi della Titolazione
Possiamo dividere la titolazione in diverse fasi, ognuna con caratteristiche specifiche:
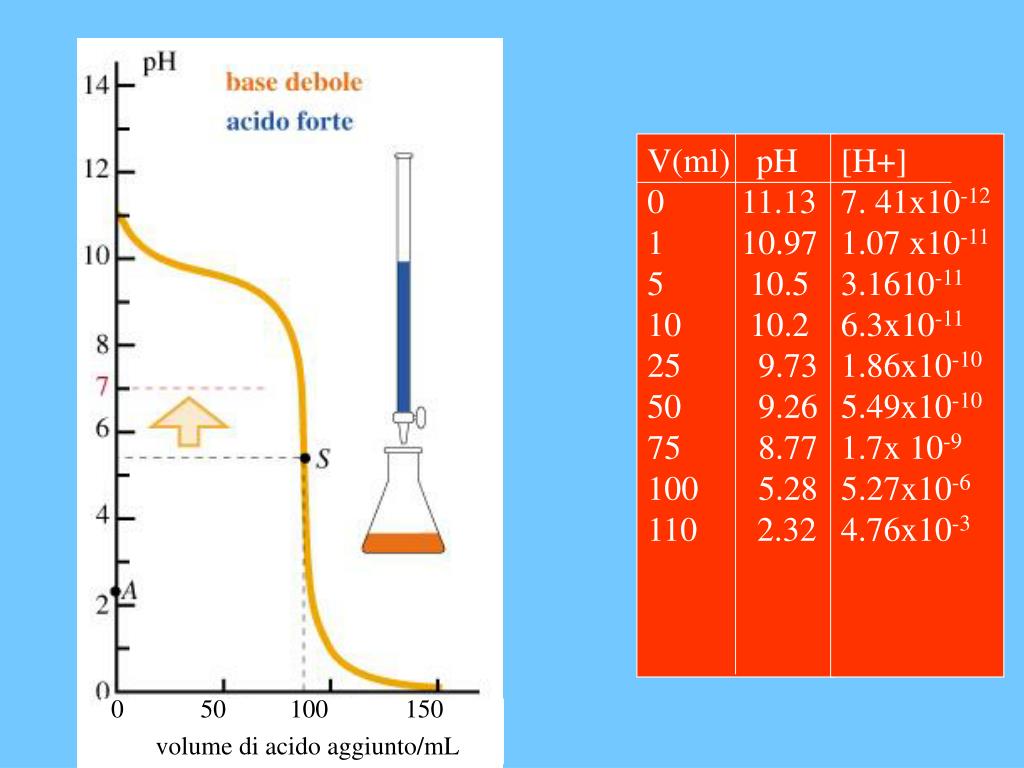
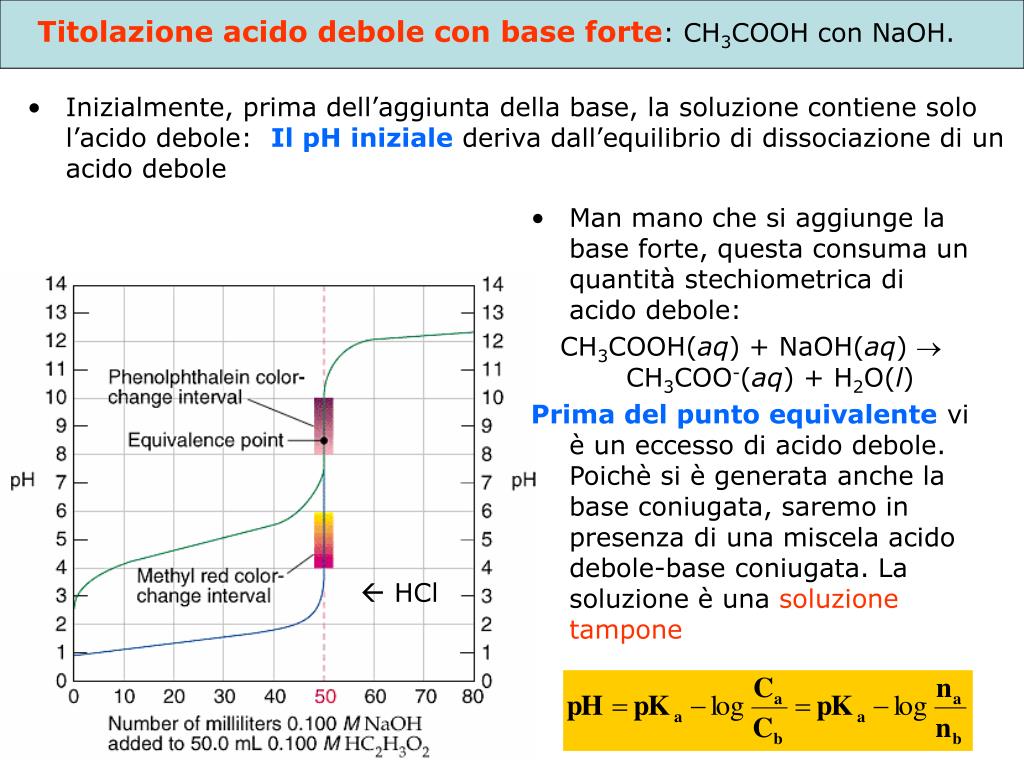
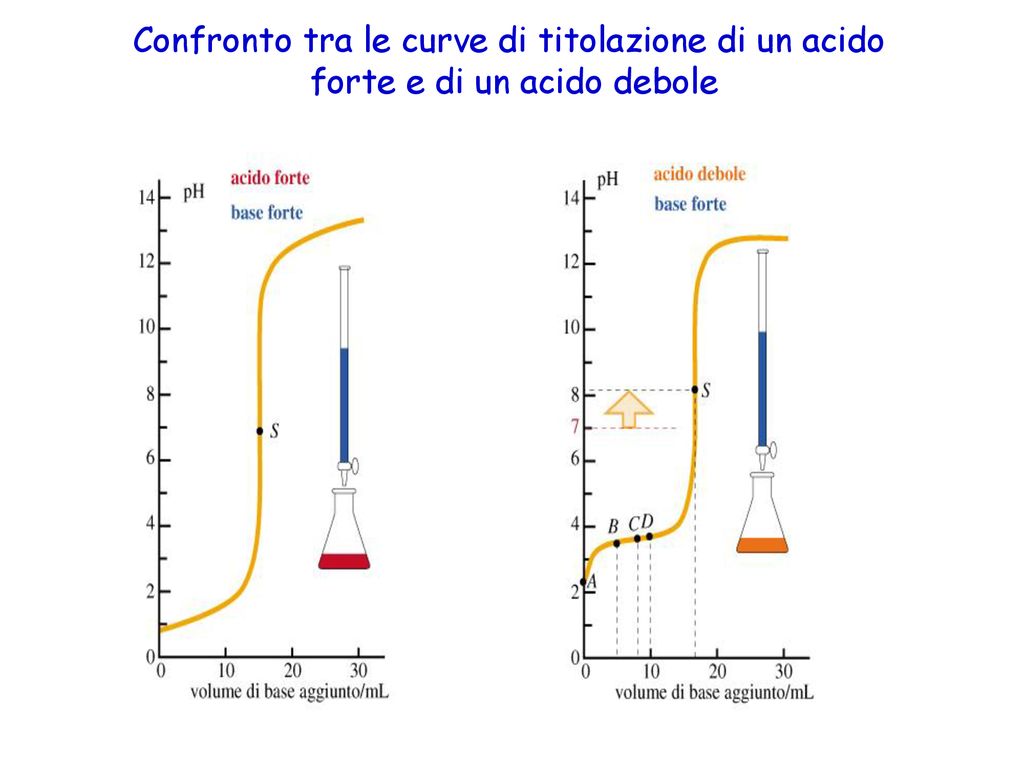
- Prima dell'aggiunta di base: Inizialmente, abbiamo solo l'acido debole in soluzione. Il pH è determinato dalla sua costante di dissociazione acida (Ka).
- Durante l'aggiunta di base: Man mano che aggiungiamo la base forte, l'acido debole viene neutralizzato e si forma il suo sale coniugato. Questa fase è governata dall'equilibrio di Henderson-Hasselbalch (ne parleremo più avanti).
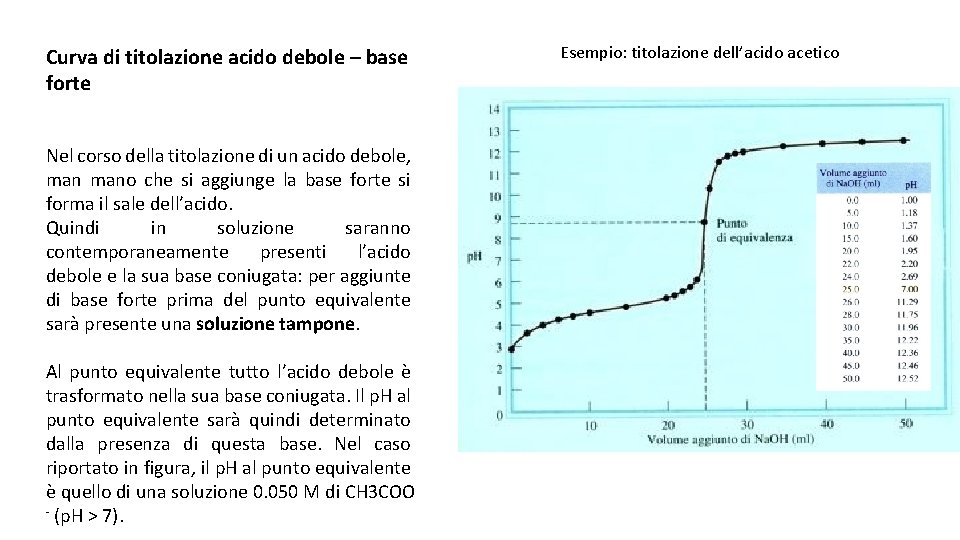
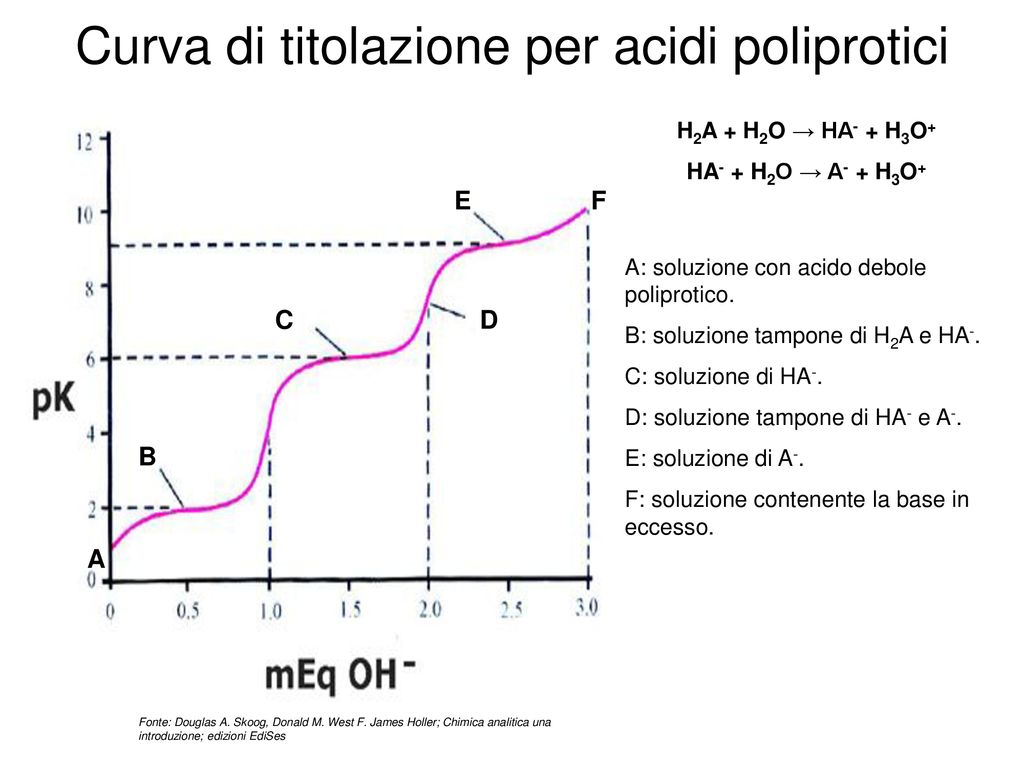
- Al punto di equivalenza: Questo è il punto in cui l'acido debole è stato completamente neutralizzato dalla base forte. A questo punto, la soluzione contiene solo il sale coniugato dell'acido debole. Il pH non è 7, perché il sale coniugato subisce idrolisi, rendendo la soluzione basica.
- Dopo il punto di equivalenza: Dopo aver superato il punto di equivalenza, l'aggiunta di ulteriore base forte determina il pH della soluzione.
3. Calcolo del pH: I Punti Chiave
Calcolare il pH in ogni fase è fondamentale per costruire la curva di titolazione. Ecco come procedere:
a. Prima dell'aggiunta di base
In questa fase, dobbiamo calcolare il pH di una soluzione di acido debole. Possiamo usare la seguente approssimazione:
[H+] ≈ √(Ka * Ca)
Dove Ka è la costante di dissociazione acida dell'acido debole e Ca è la sua concentrazione iniziale.
b. Durante l'aggiunta di base: l'Equazione di Henderson-Hasselbalch
Questa è la fase più interessante. L'equazione di Henderson-Hasselbalch ci fornisce un modo semplice per calcolare il pH:
pH = pKa + log ([A-]/[HA])
Dove pKa è il logaritmo negativo della costante di dissociazione acida, [A-] è la concentrazione del sale coniugato (acetato, nel nostro esempio), e [HA] è la concentrazione dell'acido debole (acido acetico).
Analogia: Pensa a un'altalena. Il pKa è il punto di equilibrio. L'aggiunta di base sposta l'altalena verso il sale coniugato, mentre l'aggiunta di acido la sposta verso l'acido debole. L'equazione di Henderson-Hasselbalch ti dice quanto l'altalena è inclinata, ovvero il pH della soluzione.
c. Al punto di equivalenza
Al punto di equivalenza, tutto l'acido debole è stato convertito nel suo sale coniugato. Dobbiamo quindi calcolare il pH di una soluzione di sale che subisce idrolisi. La formula è:
pH = 7 + (1/2)pKa + (1/2)log(Cs)
Dove Cs è la concentrazione del sale coniugato.
d. Dopo il punto di equivalenza
Dopo il punto di equivalenza, il pH è determinato dalla concentrazione dell'eccesso di base forte aggiunta. Possiamo calcolare il pOH e quindi il pH usando la seguente formula:
pOH = -log[OH-]
pH = 14 - pOH
4. Disegnare la Curva
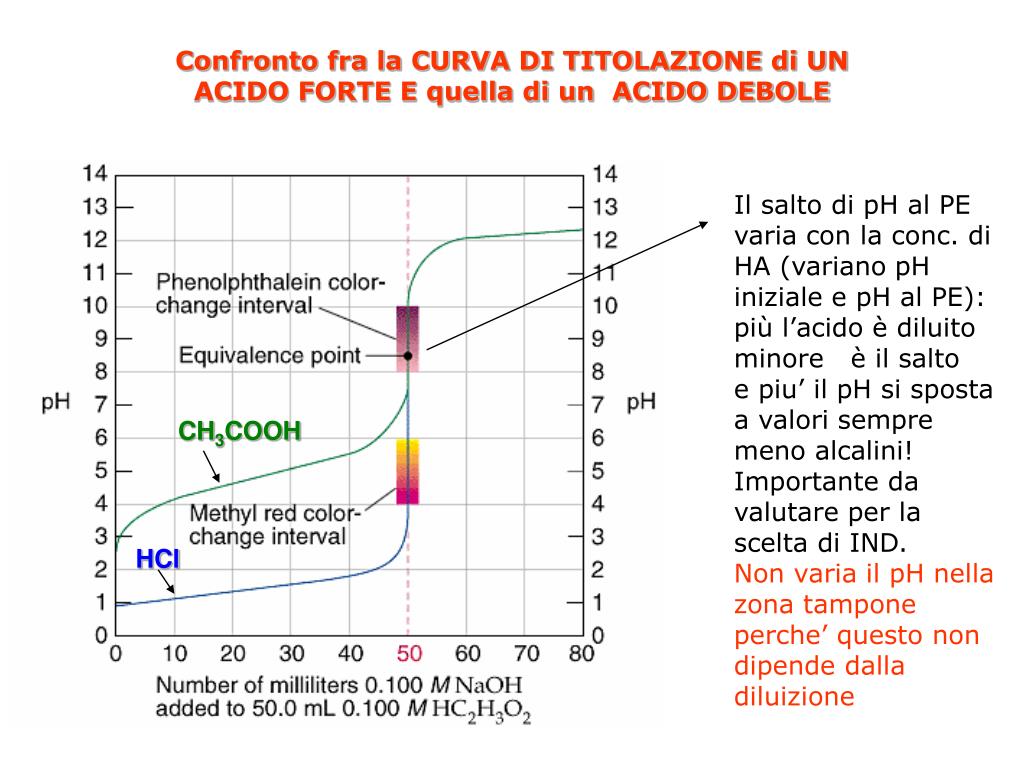
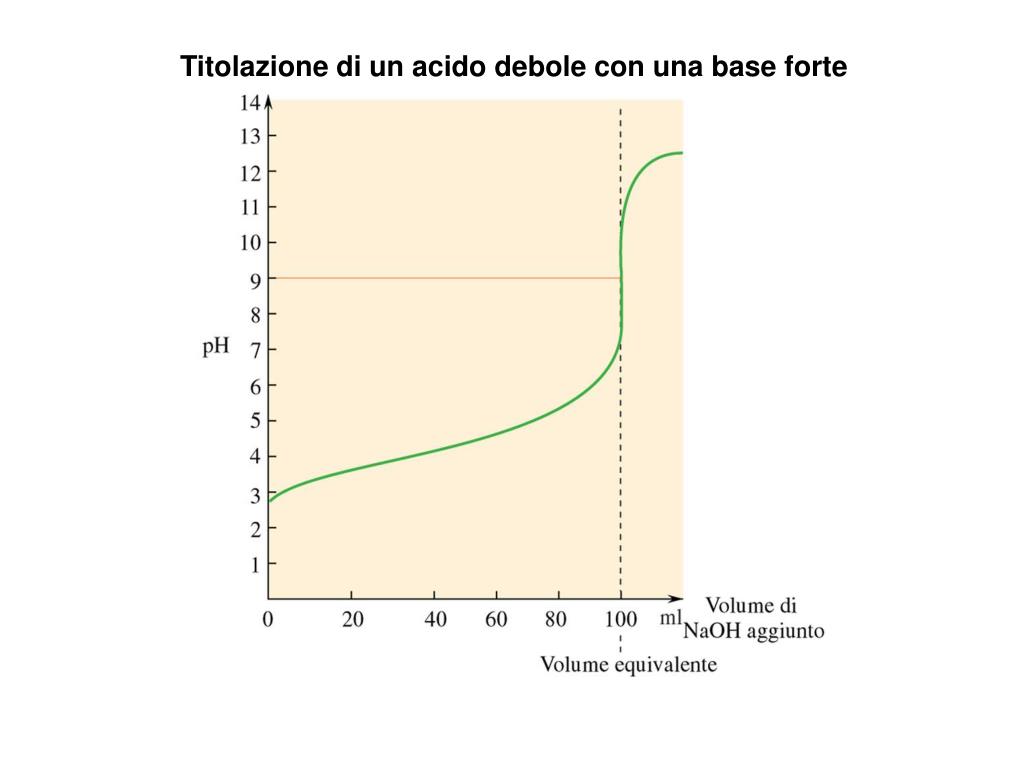
Una volta calcolati i pH per diversi volumi di base aggiunta, possiamo disegnare la curva di titolazione. L'asse x rappresenta il volume di base aggiunto, e l'asse y rappresenta il pH della soluzione. La curva avrà una forma caratteristica:
- Inizierà con un pH relativamente basso, corrispondente al pH dell'acido debole.
- Aumenterà gradualmente man mano che viene aggiunta la base.
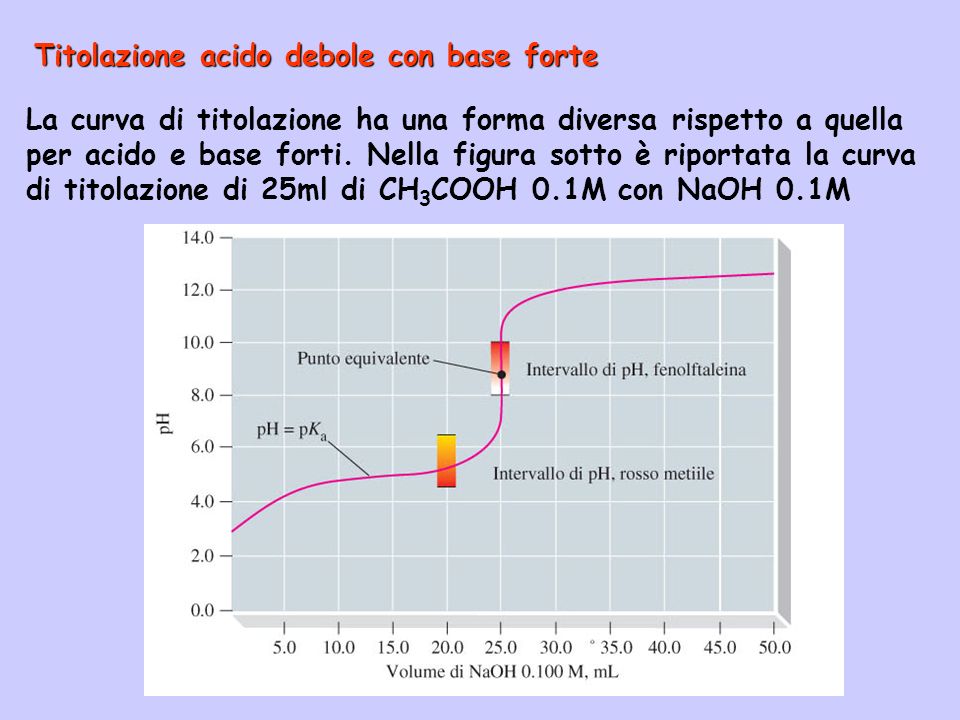
- Avrà una regione "buffer", ovvero una zona in cui il pH cambia poco all'aggiunta di base. Questa regione si trova intorno al pKa dell'acido debole.
- Aumenterà rapidamente vicino al punto di equivalenza.
- Si appiattirà di nuovo dopo il punto di equivalenza, man mano che il pH è determinato dall'eccesso di base forte.
Interpretare la Curva: Cosa Ci Dice?
La curva di titolazione non è solo un grafico, ma una fonte di informazioni preziose. Ecco cosa possiamo dedurre:
- Il pKa dell'acido debole: Il pKa corrisponde al pH al punto di semi-neutralizzazione, ovvero il punto in cui è stata aggiunta metà della base necessaria per raggiungere il punto di equivalenza. Graficamente, si trova a metà della regione buffer.
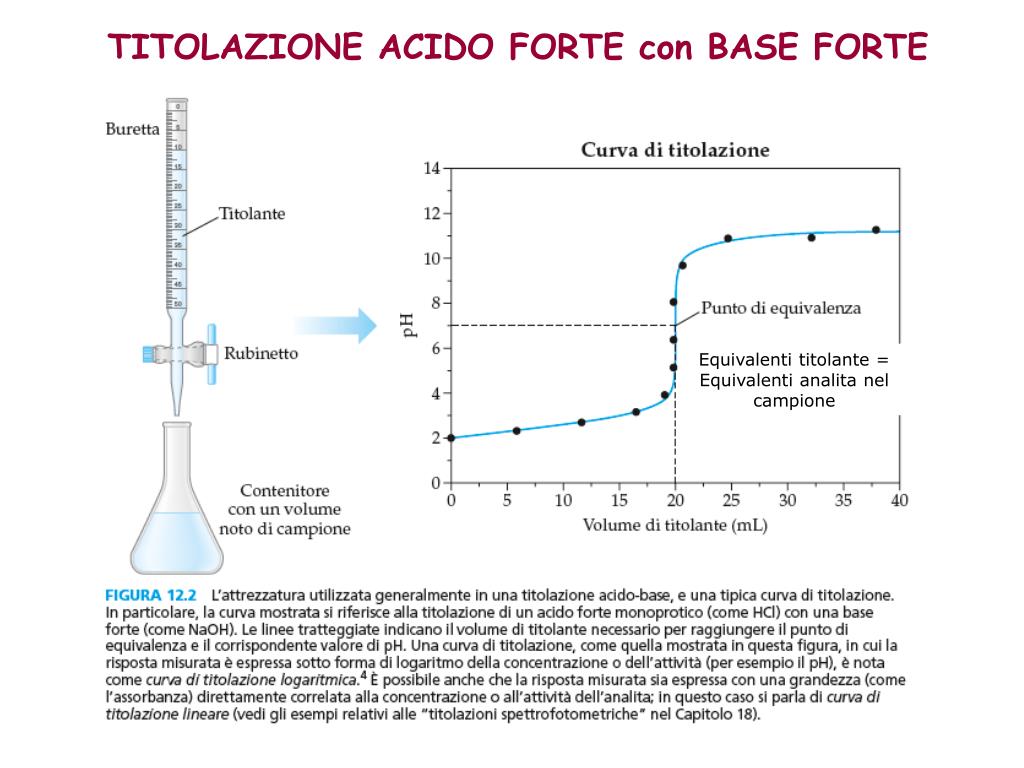
- Il punto di equivalenza: Il punto di equivalenza corrisponde al punto in cui la curva ha la pendenza massima. È il punto in cui l'acido debole è stato completamente neutralizzato.
- La scelta dell'indicatore: L'indicatore acido-base corretto è quello il cui intervallo di viraggio (la gamma di pH in cui cambia colore) comprende il punto di equivalenza.
Contro-Argomentazioni: Perché Alcuni Trovano le Titolazioni Difficili?
Alcuni potrebbero obiettare che le titolazioni sono troppo complesse e che esistono metodi più semplici per determinare la concentrazione di un acido. È vero che esistono alternative, come la spettrofotometria, ma la titolazione offre diversi vantaggi:
- È un metodo diretto: Non richiede calibrazioni o standard complessi.
- È relativamente economico: Richiede solo attrezzature di base.
- È applicabile a una vasta gamma di sostanze: Può essere utilizzata per titolare acidi, basi, ossidanti, riducenti, e molte altre sostanze.
La difficoltà percepita spesso deriva da una mancanza di comprensione dei concetti fondamentali di equilibrio acido-base e di stechiometria. Ma con un po' di pratica e un approccio sistematico, le titolazioni diventano uno strumento potente e affidabile.
Applicazioni Pratiche: Dove Entrano in Gioco le Titolazioni?
Le titolazioni acido-base hanno un impatto significativo in diversi settori:
- Industria farmaceutica: Controllo della qualità dei farmaci, determinazione della purezza dei principi attivi.
- Industria alimentare: Misurazione dell'acidità degli alimenti (ad esempio, aceto, vino, succo di frutta), controllo della fermentazione.
- Monitoraggio ambientale: Determinazione dell'acidità del suolo e dell'acqua, monitoraggio dell'inquinamento.
- Chimica clinica: Analisi del sangue e delle urine, determinazione della concentrazione di elettroliti.
Ad esempio, pensa alla produzione di yogurt. La fermentazione del latte da parte dei batteri produce acido lattico, che fa coagulare le proteine e conferisce allo yogurt la sua consistenza caratteristica. La titolazione acido-base permette di monitorare l'acidità del latte durante la fermentazione e di assicurare che il prodotto finale abbia la giusta consistenza e sapore.
In Sintesi: Consigli per Affrontare le Curve di Titolazione
Ecco alcuni consigli per affrontare le curve di titolazione acido debole-base forte:
- Comprendere la reazione chimica: Conoscere la stechiometria della reazione è fondamentale.
- Dividere la titolazione in fasi: Analizzare ogni fase separatamente semplifica il calcolo del pH.
- Utilizzare l'equazione di Henderson-Hasselbalch: È uno strumento potente per calcolare il pH nella regione buffer.
- Prestare attenzione alle unità di misura: Assicurarsi che le concentrazioni e i volumi siano espressi nelle unità corrette.
- Fare pratica!: Risolvere esercizi e simulazioni aiuta a consolidare la comprensione.
Ricorda, la pratica rende perfetti! Non scoraggiarti se all'inizio ti sembra difficile. Con un po' di impegno e la giusta guida, sarai in grado di padroneggiare le curve di titolazione acido debole-base forte.
In conclusione, la comprensione delle curve di titolazione acido debole-base forte è essenziale per chiunque lavori nel campo della chimica. Spero che questo articolo ti abbia fornito una base solida per affrontare questa sfida. Ora, sei pronto a mettere in pratica le tue conoscenze? Quale titolazione ti incuriosisce di più e vorresti approfondire?