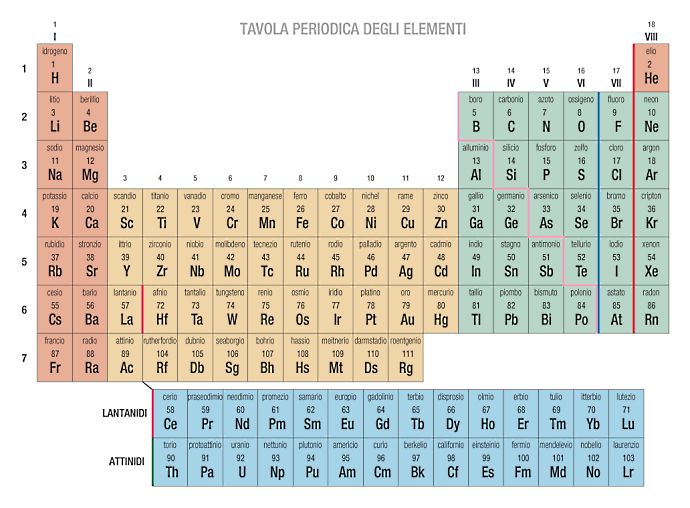
Cosa Indicano I Gruppi Nella Tavola Periodica
Hai mai guardato la tavola periodica degli elementi e ti sei chiesto cosa significassero tutte quelle colonne verticali? Queste colonne, chiamate gruppi, non sono lì per caso! Contengono preziose informazioni sulle proprietà chimiche e fisiche degli elementi. Questo articolo è pensato per chiunque voglia capire meglio come la tavola periodica è organizzata e cosa possiamo imparare dai suoi gruppi, che tu sia uno studente alle prime armi o semplicemente curioso di scienza.
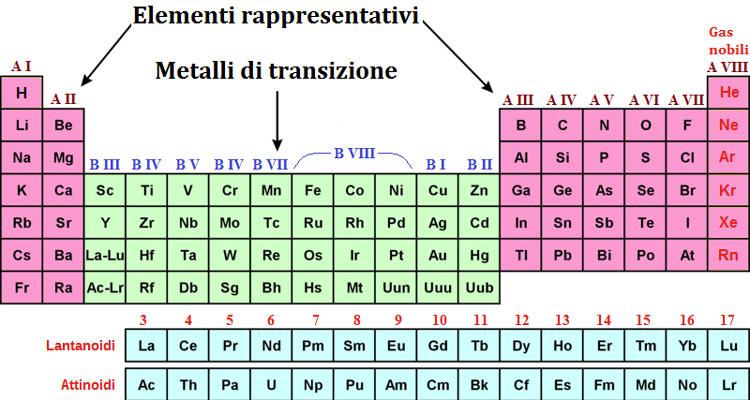
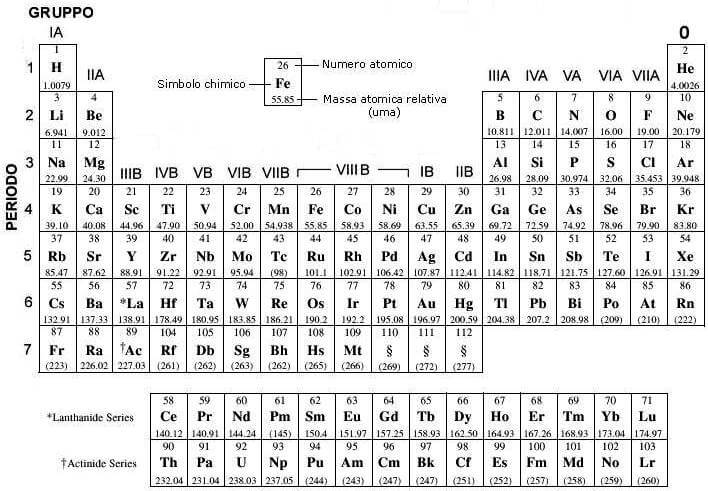
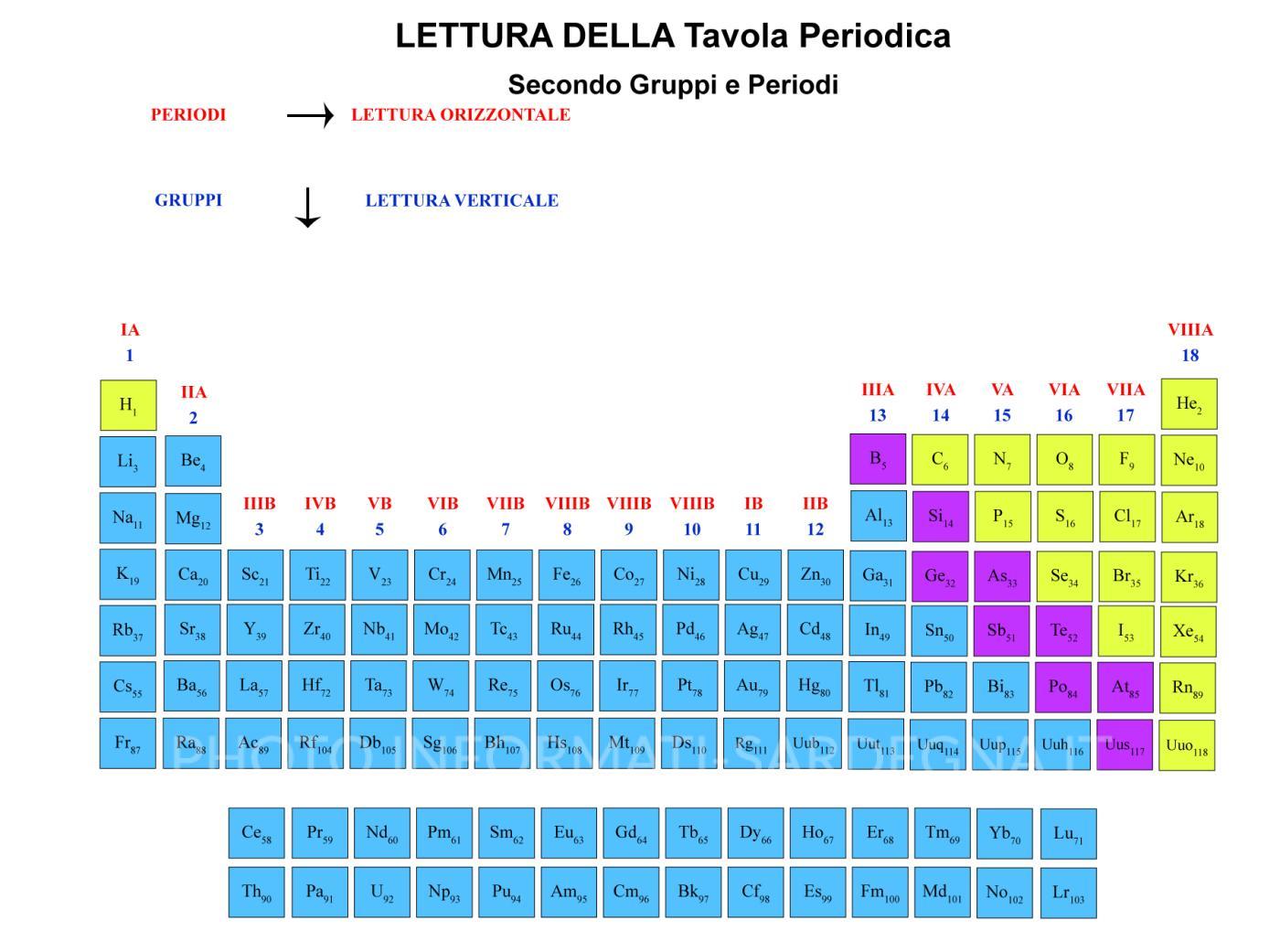
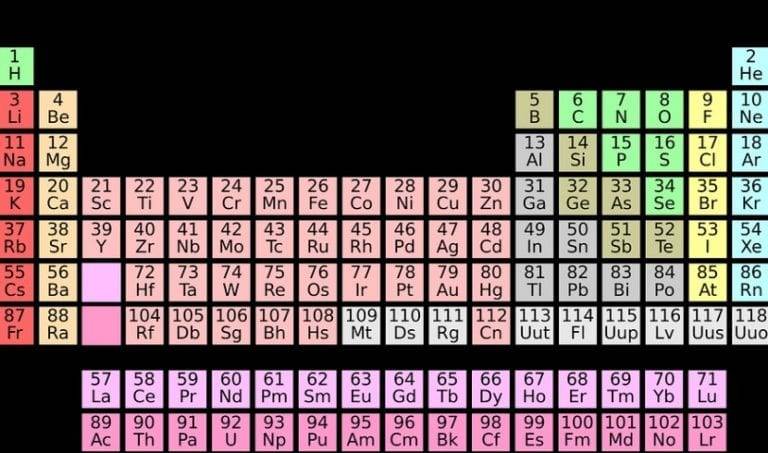
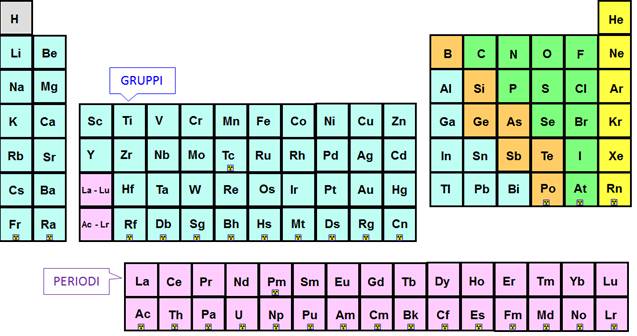
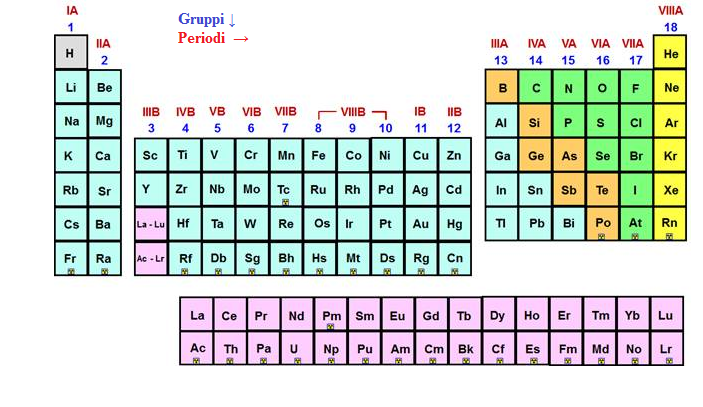
Cosa sono i Gruppi nella Tavola Periodica?
I gruppi nella tavola periodica sono le colonne verticali. Ogni gruppo contiene elementi che condividono simili proprietà chimiche. Queste somiglianze derivano dalla loro configurazione elettronica, in particolare dal numero di elettroni presenti nel loro guscio di valenza (l'ultimo livello energetico occupato dagli elettroni).
Immagina di avere diverse famiglie di elementi chimici. Ogni famiglia (gruppo) ha delle caratteristiche in comune, proprio come le persone che appartengono alla stessa famiglia. Ad esempio, alcuni gruppi reagiscono violentemente con l'acqua, mentre altri sono estremamente stabili e inerti.
Il Guscio di Valenza: La Chiave delle Proprietà
Il numero di elettroni nel guscio di valenza determina come un elemento reagirà con altri elementi per formare composti. Gli elementi nello stesso gruppo hanno lo stesso numero di elettroni di valenza, e quindi tendono a comportarsi in modo simile durante le reazioni chimiche.
Ad esempio:
- Gli elementi del Gruppo 1 (i metalli alcalini) hanno un solo elettrone di valenza e tendono a perderlo facilmente, formando ioni positivi (+1).
- Gli elementi del Gruppo 17 (gli alogeni) hanno sette elettroni di valenza e tendono ad acquisire un elettrone, formando ioni negativi (-1).
I Gruppi Principali: Un Viaggio Attraverso la Tavola Periodica
Analizziamo alcuni dei gruppi più importanti e le loro caratteristiche distintive:
Gruppo 1: I Metalli Alcalini
I metalli alcalini (Litio, Sodio, Potassio, Rubidio, Cesio e Francio) sono estremamente reattivi e non si trovano mai allo stato puro in natura. Reagiscono violentemente con l'acqua, formando idrogeno gassoso e idrossidi metallici (basi forti). La loro reattività aumenta scendendo lungo il gruppo.
Esempio: Il sodio (Na) reagisce con l'acqua secondo la seguente reazione:
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
Questa reazione produce calore e può anche causare un'esplosione se il metallo alcalino è presente in quantità sufficiente.
Gruppo 2: I Metalli Alcalino-Terrosi
I metalli alcalino-terrosi (Berillio, Magnesio, Calcio, Stronzio, Bario e Radio) sono anch'essi reattivi, ma meno dei metalli alcalini. Hanno due elettroni di valenza e tendono a formare ioni positivi (+2). Il calcio e il magnesio sono essenziali per la vita, presenti nelle ossa e nei denti.
Esempio: Il calcio (Ca) è un componente fondamentale del calcare e del marmo (carbonato di calcio, CaCO3).
Gruppo 13: Il Gruppo del Boro
Il gruppo del boro (Boro, Alluminio, Gallio, Indio e Tallio) mostra una varietà di proprietà. Il boro è un metalloide (con proprietà intermedie tra metalli e non metalli), mentre l'alluminio è un metallo leggero ampiamente utilizzato nell'industria.
Esempio: L'alluminio (Al) è utilizzato in lattine, aeroplani e pentole per via della sua leggerezza e resistenza alla corrosione.
Gruppo 14: Il Gruppo del Carbonio
Il gruppo del carbonio (Carbonio, Silicio, Germanio, Stagno e Piombo) è fondamentale per la chimica organica, poiché il carbonio è la base di tutte le molecole organiche. Il silicio è un semiconduttore importante per l'elettronica.
Esempio: Il carbonio (C) esiste in diverse forme allotropiche, tra cui il diamante (estremamente duro) e la grafite (utilizzata nelle matite).
Gruppo 15: Il Gruppo dell'Azoto
Il gruppo dell'azoto (Azoto, Fosforo, Arsenico, Antimonio e Bismuto) include elementi essenziali per la vita (azoto e fosforo) e elementi tossici (arsenico). L'azoto è un componente importante dell'aria che respiriamo.
Esempio: L'azoto (N) è utilizzato nella produzione di fertilizzanti e nell'industria chimica.
Gruppo 16: Il Gruppo dell'Ossigeno (Calcogeni)
Il gruppo dell'ossigeno (Ossigeno, Zolfo, Selenio, Tellurio e Polonio), noto anche come calcogeni, include l'ossigeno, essenziale per la respirazione e la combustione, e lo zolfo, utilizzato nella produzione di acido solforico.
Esempio: L'ossigeno (O) costituisce circa il 21% dell'atmosfera terrestre ed è fondamentale per la vita animale.
Gruppo 17: Gli Alogeni
Gli alogeni (Fluoro, Cloro, Bromo, Iodio e Astato) sono molto reattivi e si trovano spesso in natura sotto forma di sali. Hanno sette elettroni di valenza e tendono ad acquisire un elettrone per formare ioni negativi (-1). Il cloro è utilizzato come disinfettante e il fluoro viene aggiunto al dentifricio per prevenire la carie.
Esempio: Il cloro (Cl) è utilizzato per disinfettare l'acqua potabile e le piscine.
Gruppo 18: I Gas Nobili
I gas nobili (Elio, Neon, Argon, Kripton, Xenon e Radon) sono estremamente inerti e non reagiscono facilmente con altri elementi. Hanno una configurazione elettronica completa (8 elettroni di valenza, tranne l'elio che ne ha 2), il che li rende molto stabili. Sono utilizzati in lampade, insegne luminose e applicazioni criogeniche.
Esempio: L'elio (He) è utilizzato per gonfiare i palloncini e per raffreddare magneti superconduttori.
Tendencies all'interno dei Gruppi
Oltre alle somiglianze, è importante notare che le proprietà degli elementi cambiano anche all'interno di un gruppo. Ad esempio:
- Raggio atomico: Generalmente aumenta scendendo lungo il gruppo, poiché si aggiungono nuovi livelli energetici con più elettroni.
- Energia di ionizzazione: Generalmente diminuisce scendendo lungo il gruppo, poiché gli elettroni di valenza sono più lontani dal nucleo e quindi più facili da rimuovere.
- Elettronegatività: Generalmente diminuisce scendendo lungo il gruppo, poiché gli atomi tendono meno ad attrarre elettroni.
- Reattività (per i metalli): Generalmente aumenta scendendo lungo il gruppo, poiché gli elettroni di valenza sono più facili da perdere.
- Reattività (per i non metalli): Generalmente diminuisce scendendo lungo il gruppo, poiché gli elettroni sono meno attratti dal nucleo.
Queste tendenze ci aiutano a prevedere le proprietà degli elementi e a capire come si comporteranno in diverse reazioni chimiche.
Perché Comprendere i Gruppi è Importante?
Capire i gruppi nella tavola periodica ti permette di:
- Prevedere le proprietà degli elementi: Sapendo a quale gruppo appartiene un elemento, puoi farti un'idea delle sue proprietà chimiche e fisiche.
- Comprendere le reazioni chimiche: Conoscere la configurazione elettronica degli elementi ti aiuta a capire come reagiranno tra loro per formare composti.
- Apprezzare l'organizzazione della materia: La tavola periodica è un'organizzazione logica e coerente degli elementi che costituiscono tutto ciò che ci circonda.
- Semplificare lo studio della chimica: Invece di memorizzare le proprietà di ogni singolo elemento, puoi concentrarti sulle proprietà dei gruppi.
La tavola periodica non è solo un elenco di elementi, ma una mappa che ci guida alla scoperta delle proprietà della materia. I gruppi sono una delle sue chiavi di lettura più importanti, offrendoci una comprensione profonda e intuitiva del mondo che ci circonda. Spero che questo articolo ti abbia aiutato a decifrare questo importante strumento e ti abbia invogliato ad approfondire ulteriormente la tua conoscenza della chimica.