Come Si Calcola La Massa Molecolare

Ti sei mai chiesto quanto pesa una singola molecola? Potrebbe sembrare una domanda astrusa, ma la capacità di calcolare la massa molecolare è fondamentale in molti campi, dalla chimica alla biologia, fino alla preparazione di ricette perfette in cucina! Spesso ci troviamo di fronte a formule complesse e numeri che sembrano incomprensibili, e la confusione può essere tanta. Questo articolo è pensato proprio per te: ti guiderò passo dopo passo, rendendo il calcolo della massa molecolare semplice, intuitivo e persino... divertente!
Comprendere le Basi: Atomi, Molecole e Masse Atomiche
Prima di tuffarci nei calcoli, è essenziale avere ben chiari alcuni concetti fondamentali. Un atomo è l'unità fondamentale della materia, l'elemento costitutivo di tutto ciò che ci circonda. Una molecola è formata da due o più atomi uniti tra loro da legami chimici. Pensa all'acqua (H₂O): due atomi di idrogeno (H) legati a un atomo di ossigeno (O).
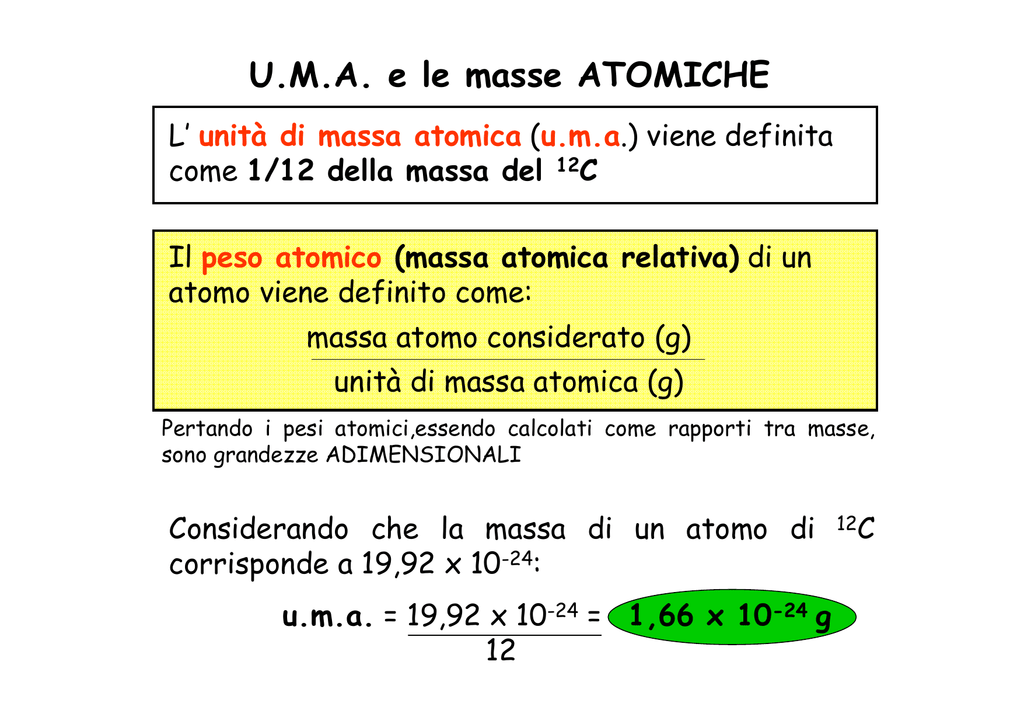
Ora, ogni atomo ha una sua massa, espressa in unità di massa atomica (u.m.a.). Queste masse sono riportate nella tavola periodica degli elementi. Ad esempio, la massa atomica dell'idrogeno (H) è circa 1 u.m.a., mentre quella dell'ossigeno (O) è circa 16 u.m.a.
Perché è importante la tavola periodica? Semplice! È la tua "bibbia" per trovare le masse atomiche di tutti gli elementi. Immagina di dover preparare una torta seguendo una ricetta. Allo stesso modo, la tavola periodica ti fornisce gli "ingredienti" (le masse atomiche) necessari per "calcolare" la massa molecolare.
Il Concetto di Massa Molecolare: Cos'è e Perché è Importante
La massa molecolare, detta anche peso molecolare, è la somma delle masse atomiche di tutti gli atomi presenti in una molecola. In altre parole, è il "peso" di una singola molecola, espresso in u.m.a.
Perché è così importante calcolare la massa molecolare? Ecco alcuni motivi:
- Chimica: Permette di calcolare le quantità di reagenti e prodotti necessari per una reazione chimica. Senza conoscere le masse molecolari, sarebbe impossibile bilanciare le equazioni chimiche e ottenere i risultati desiderati.
- Farmacia: Fondamentale per la preparazione di farmaci e la determinazione delle dosi corrette. Un errore nel calcolo della massa molecolare potrebbe avere conseguenze gravi per la salute dei pazienti.
- Biologia: Essenziale per studiare le macromolecole biologiche come proteine, DNA e carboidrati. La conoscenza della massa molecolare aiuta a comprendere la loro struttura, funzione e interazioni.
- Cucina: Anche in cucina! Ad esempio, per calcolare la concentrazione di sale in una soluzione o per determinare la quantità di lievito necessaria per far lievitare un impasto.
Come Calcolare la Massa Molecolare: Passo Dopo Passo
Ora veniamo al dunque: come si calcola concretamente la massa molecolare? Segui questi semplici passaggi:
Passo 1: Scrivere la Formula Chimica
Il primo passo è avere ben chiara la formula chimica della molecola che ti interessa. Ad esempio, l'acqua è H₂O, il glucosio è C₆H₁₂O₆ e il cloruro di sodio (sale da cucina) è NaCl.
Passo 2: Individuare le Masse Atomiche
Utilizza la tavola periodica per trovare le masse atomiche di tutti gli elementi presenti nella formula. Arrotonda le masse atomiche al numero intero più vicino per semplificare i calcoli. Ad esempio:
- H (Idrogeno): 1 u.m.a.
- O (Ossigeno): 16 u.m.a.
- C (Carbonio): 12 u.m.a.
- Na (Sodio): 23 u.m.a.
- Cl (Cloro): 35.5 u.m.a. (solitamente arrotondato a 35 u.m.a. per semplicità)
Passo 3: Moltiplicare le Masse Atomiche per il Numero di Atomi
Nella formula chimica, ogni elemento è seguito da un numero (pedice) che indica quanti atomi di quell'elemento sono presenti nella molecola. Moltiplica la massa atomica di ciascun elemento per il suo pedice. Se non c'è pedice, significa che c'è un solo atomo di quell'elemento.
Ad esempio, per l'acqua (H₂O):
- Idrogeno (H): 1 u.m.a. x 2 = 2 u.m.a.
- Ossigeno (O): 16 u.m.a. x 1 = 16 u.m.a.
Passo 4: Sommare i Risultati
Somma tutti i risultati ottenuti nel passo precedente. Il risultato finale è la massa molecolare della molecola.
Ad esempio, per l'acqua (H₂O):
2 u.m.a. (idrogeno) + 16 u.m.a. (ossigeno) = 18 u.m.a.
Quindi, la massa molecolare dell'acqua è 18 u.m.a.
Esempi Pratici: Mettiamoci alla Prova!
Vediamo alcuni esempi per consolidare quanto appreso:
Esempio 1: Cloruro di Sodio (NaCl)
- Sodio (Na): 23 u.m.a. x 1 = 23 u.m.a.
- Cloro (Cl): 35.5 u.m.a. x 1 = 35.5 u.m.a.
- Massa molecolare di NaCl: 23 u.m.a. + 35.5 u.m.a. = 58.5 u.m.a.
Esempio 2: Glucosio (C₆H₁₂O₆)
- Carbonio (C): 12 u.m.a. x 6 = 72 u.m.a.
- Idrogeno (H): 1 u.m.a. x 12 = 12 u.m.a.
- Ossigeno (O): 16 u.m.a. x 6 = 96 u.m.a.
- Massa molecolare di C₆H₁₂O₆: 72 u.m.a. + 12 u.m.a. + 96 u.m.a. = 180 u.m.a.
Esempio 3: Acido Solforico (H₂SO₄)
- Idrogeno (H): 1 u.m.a. x 2 = 2 u.m.a.
- Zolfo (S): 32 u.m.a. x 1 = 32 u.m.a.
- Ossigeno (O): 16 u.m.a. x 4 = 64 u.m.a.
- Massa molecolare di H₂SO₄: 2 u.m.a. + 32 u.m.a. + 64 u.m.a. = 98 u.m.a.
Consigli Utili e Trucchi del Mestiere
Ecco alcuni consigli per rendere il calcolo della massa molecolare ancora più semplice e preciso:
- Utilizza una calcolatrice: Soprattutto per molecole complesse, una calcolatrice ti aiuterà a evitare errori di calcolo.
- Arrotonda con criterio: Se devi arrotondare le masse atomiche, fallo al numero intero più vicino per semplificare i calcoli. Ricorda però che un arrotondamento eccessivo può portare a imprecisioni nel risultato finale.
- Verifica i risultati: Controlla sempre i tuoi calcoli per assicurarti di non aver commesso errori.
- Ricorda le masse atomiche più comuni: Con il tempo, memorizzerai le masse atomiche degli elementi più comuni (H, O, C, N, Na, Cl), il che ti farà risparmiare tempo.
- Utilizza risorse online: Esistono molti siti web e app che calcolano automaticamente la massa molecolare di una sostanza. Sono utili per verificare i tuoi risultati o per calcolare la massa molecolare di molecole particolarmente complesse.
Conclusione
Calcolare la massa molecolare può sembrare complicato all'inizio, ma con un po' di pratica diventa un'operazione semplice e intuitiva. Ricorda i concetti fondamentali, segui i passaggi descritti e utilizza gli strumenti a tua disposizione. Ora hai tutti gli strumenti necessari per "pesare" le molecole! Buon calcolo!